
已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“ ”;②合理利用核能符合“低碳经济”的要求,
”;②合理利用核能符合“低碳经济”的要求,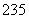 92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
A.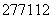 Cn的原子核内中子数与核外电子数之差为55
Cn的原子核内中子数与核外电子数之差为55
B.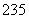 92U和
92U和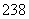 92U是同位素,核反应属于化学变化
92U是同位素,核反应属于化学变化
C.40Ca2+与18O 具有相同的电子数
具有相同的电子数
D.Si2O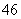 中质子总数为80
中质子总数为80
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(下图是一种合成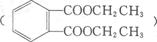 路线:
路线:
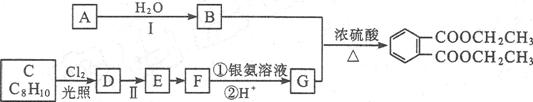
已知以下信息:
有机化合物A可用来衡量一个国家石油化学工业发展水平。
② 有机化合物C的核磁共振氢谱显示其有3种不同化学环境的氢原子。
③ 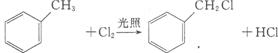
根据上述信息回答下列问题:
(1)A的结构式是 。
(2)B的结构简式为 。
(3)C生成D的化学方程式为 。
(4)反应Ⅱ的试剂是 ,该反应类型为 。
(5)在G的同分异构体中,既能与新制的Cu(OH)2悬浊液在加热条件下反应生成砖红色沉淀,又能与碳酸钠反应生成二氧化碳,还能使FeCl3溶液显色的有
种,所有这些同分异构体中,不同化学环境氢原子的种数 (填“相同” “不相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为______。列式表示Al单质的密度________ g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子能与F2发生加成反应,其加成产物为______,C60分子的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为________。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是________(填字母)。
a.晶体的密度:干冰>冰
b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰
d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是________(填字母)。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如下图,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为________,B原子与N原子之间共价键与配位键的数目比为________,一个晶胞中N原子数目为________。
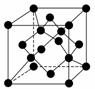
(5)C与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为________,金属铜采用面心立方最密堆积(在晶胞的顶点和面心均含有一个Cu原子),则Cu的晶体中Cu原子的配位数为________。
已知Cu单质的晶体密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同。当它作为原子的次外层时,其电子数比(n-1)层多10个,则此电子层是( )
A.K层 B.L层 C.M层 D.N层
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.X+、Y3+
C.Y3+、Z2- D.X+、Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.食用植物油是人体的营养物质
B.分馏、干馏是物理变化,裂化、裂解是化学变化
C.淀粉、蛋白质、葡萄糖都是高分子化合物
D.甲烷、汽油、酒精都是碳氢化合物,都可作燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_________________。
(2)用该方法获得的Na2S2O3·H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】 假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:________________________________________________________________________。
【查阅资料】 Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。
【判断与思考】 某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?________(填“合理”或“不合理”)并说明理由:_________________________________________。
【设计方案进行实验】 基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
(3)已知:2Na2S2O3+I2===2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com