
 A:在较高温度下和Br2按物质的量之比1:1发生加成反应的方程式:
A:在较高温度下和Br2按物质的量之比1:1发生加成反应的方程式: 与溴发生1:1加成,只断裂一个碳碳双键;A和HBr按物质的量之比1:1发生加成反应时,
与溴发生1:1加成,只断裂一个碳碳双键;A和HBr按物质的量之比1:1发生加成反应时,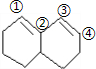 与HBr发生1:1加成,只断裂1碳碳键,依据溴原子的位置判断产物的种树;
与HBr发生1:1加成,只断裂1碳碳键,依据溴原子的位置判断产物的种树;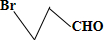 ;
; ;
; ,
, .
. 与Br2加成的方程式为:
与Br2加成的方程式为: +Br2→
+Br2→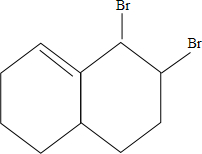 ;
; +Br2→
+Br2→ ;
; 与HBr发生1:1加成,可能的产物有
与HBr发生1:1加成,可能的产物有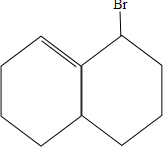 、
、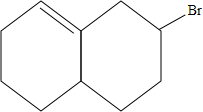 、
、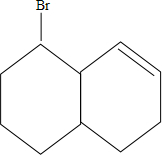 、
、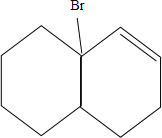 、
、 、
、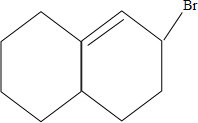 ,共6种;
,共6种;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在容积相同的不同密闭容器内,分别充入同量的N2和H2,在不同温度,任其发生反应N2+3H2?2NH3,在第7秒时分别测定其中NH3的体积分数φ(NH3),并绘成如图曲线.
在容积相同的不同密闭容器内,分别充入同量的N2和H2,在不同温度,任其发生反应N2+3H2?2NH3,在第7秒时分别测定其中NH3的体积分数φ(NH3),并绘成如图曲线.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com