
【题目】下面两表分别列出了CO和N2 的某些性质及相关键能,有关说法不正确的是
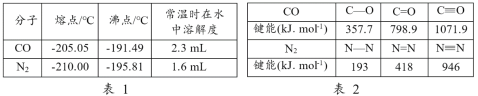
A.CO与N2的价电子总数相等
B.由表2可知,CO的活泼性不及N2
C.由表1可知,CO的熔沸点高于N2,是因为CO分子间作用力大于N2
D.由表2可知,σ键的稳定性不一定强于π键
【答案】B
【解析】
A.CO的价电子总数为6+4=10,N2的价电子总数为5+5=10,故A正确;
B.一个CO分子中含有2个π键,根据表中键能知,CO中第一个π键的键能是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,N2中第一个π键的键能是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,CO中第一个π键的键能较小,所以CO的第一个π键比N2更容易断,所以一氧化碳比氮气活泼,故B错误;
C.一氧化碳和氮气形成晶体为分子晶体,分子间作用力越大,沸点越高,由表 1 可知,CO 的熔沸点高于 N2,是因为 CO 为极性分子,分子间作用力大于 N2 ,故C正确;
D.根据表格数据,CO分子中有一个π键的键能为798.9kJ/mol-357.7kJ/mol=441.2 kJ/mol,键能大于C-O单键即σ键的键能,更稳定,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(含2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
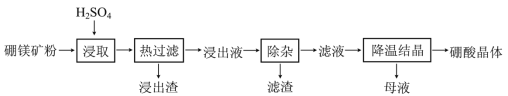
已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0 g、8.7 g、14.8 g、40.2g。Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
(1)“浸取”时主要反应的化学方程式为_____________________。
(2)“浸取”后,采用“热过滤”的目的是___________________________。
(3)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有其他杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是__________。H2O2的作用是______(用离子方程式表示)。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4H2O,应采取的措施是将“母液”蒸发浓缩后,最佳结晶条件是_____________。
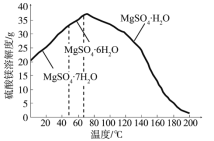
A. 升温结晶 B. 降温结晶 C. 加压升温结晶 D. 降压降温结晶
(5)在实际生产中为了提高原料的综合利用率,可以利用除杂后滤渣作为提炼铝的原料,工艺流程为:
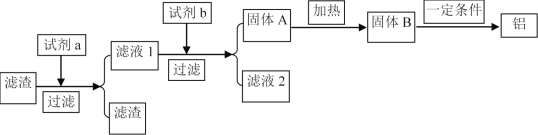
试剂a可选用________(化学式)溶液,若试剂b为AlCl3则由滤液得固体A的离子反应方程式为___________,在实际工业生产中,流程中的一定条件指的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊接性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
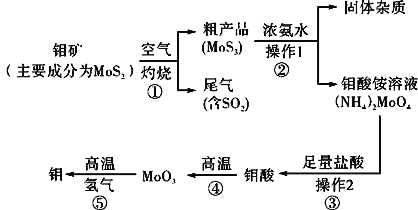
(1)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂:___。
(2)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有:___。
(3)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为___。
(4)工业上制备还原性气体CO和H2的反应原理为CO2+CH4![]() 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O![]() CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为___。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示表示页岩气中某些烃类的结构模型:

(1)有机物甲的名称为____________,有机物甲与有机物乙互为____________。
(2)有机物乙的一氯取代物有________种,请你根据甲烷分子结构示意图推测,有机物乙中最多有________个C原子在同一平面内。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如图:![]() 。下列有关说法不正确的是
。下列有关说法不正确的是
A.分子式为C3H4O3B.分子中σ键与π键个数之比为3:1
C.分子中既有极性键也有非极性键D.分子中碳原子的杂化方式全部为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
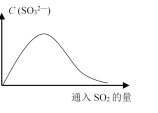
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4) 并探究其性质。资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制备K2FeO4 (夹持装置略)
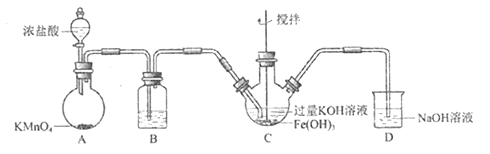
(1)简述检验该装置气密性的方法:________________________________________。
(2)A为氯气发生装置。A中化学反应的被还原的元素是____________________________。
(3)装置B的作用是除杂,所用试剂为_____________________________________。
(4)C中得到紫色固体和溶液。请写出C中发生的化学反应并标出电子转移的方向和数目:_________。 此反应表明:氧化性Cl2______FeO42-(填“>”或“<”)。
(5) C中除了发生③中的反应,还发生化学反应的离子方程式是:______________________。
(6)用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。此实验得出Cl2和FeO42-的氧化性强弱关系与制备实验时得出的结论相反,原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、CH2=CH﹣COOH和油酸(C17H33COOH)
B、12C60和石墨
C、![]() 和
和![]()
D、35Cl和37Cl
E、乙醇和乙二醇
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气![]() L
L
B.NA可表示为:![]()
C.反应后溶液中的Cl―数目为:![]()
D.反应后溶液中的H+数目为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com