
分析 ①根据化合物中各元素的质量比=各原子的相对原子质量×原子个数进行分析解答;
②由硫的质量分数求得1t矿石中CuFeS2的质量,并根据方程式求得SO2的质量,并根据硫元素守恒求硫酸的质量.
解答 解:①∵黄铜矿的成分为CuFeS2、SiO2其中硫的质量分数为a%
∴$\frac{W(s)}{W(Cu)}$=$\frac{m(s)}{m(Cu)}$即$\frac{a%}{W(Cu)}$=$\frac{32×2}{64}$,W(Cu)=a%,
②由①∵黄铜矿的成分为CuFeS2、SiO2其中硫的质量分数为a%
∴$\frac{w(s)}{w(CuFe{S}_{2})}$=$\frac{m(s)}{m(CuFe{S}_{2})}$即$\frac{a%}{w(CuFe{S}_{2})}$=$\frac{32×2}{64+56+32×2}$,W(CuFeS2)=$\frac{23}{8}$a%
m(CuFeS2)=1×$\frac{23}{8}$a%=$\frac{23a}{100}$t
CuFeS2+O2$\frac{\underline{\;高温\;}}{\;}$Cu+FeS+SO2
184 64
$\frac{23a}{100}$×98% m
$\frac{184}{\frac{23a}{100}×98%}$=$\frac{64}{m}$,m=0.0784at
∴m(SO2)=0.0784a×0.96t
n(SO2)=$\frac{m(SO2)}{M(SO2)}$=$\frac{0.0784a×0.96t}{64}$=0.001176at
根据硫原子守恒n(H2SO4)=n(SO2)=0.001176at
m(H2SO4)=$\frac{n({H}_{2}S{O}_{4})×M({H}_{2}S{O}_{4})}{W({H}_{2}S{O}_{4})}$=$\frac{0.1176a×98}{98%}$=0.1176at,
故答案为:a%;0.1176at.
点评 本题考查了化合物中各元素的质量比=各原子的相对原子质量×原子个数进行,以及元素守恒巧妙的应用可以为本题解题带来很大的方便,化学方程式正确书写也是解题的关键,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Fe2+、NH4+、SO42-、S2-可以大量共存 | |
| B. | 该溶液中,H+、K+、NO3-、SO42-可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓硫酸,反应的离子方程式为:ClO2-+4H++3 Cl-=2Cl2↑+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2 | |
| B. | 2 min内A的反应速率为0.3 mol•(L•min)-1 | |
| C. | 维持其他条件不变,将该混合物转移到固定容积为1 L的密闭容器中,再次平衡后H的浓度将大于0.4 mol•L-1 | |
| D. | 维持其他条件不变,再向容器中加入足量物质 A,最终H的浓度将达到0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
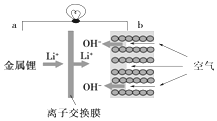
| A. | a为电源正极 | B. | 电流从a流向b | ||
| C. | 离子交换膜为阳离子交换膜 | D. | b电极处,O2失电子生成OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是3,3,5,5-四甲基庚烷;
的名称是3,3,5,5-四甲基庚烷;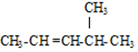 的名称是4-甲基-2-戊烯;
的名称是4-甲基-2-戊烯; ,则键线式为
,则键线式为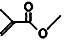 的物质的分子式为C5H8O2;
的物质的分子式为C5H8O2; 的一氯代物有5种;
的一氯代物有5种;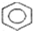 -CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
-CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、I-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、NH4+可以大量共存 | |
| C. | 该溶液中,Fe2+、Fe3+、Cl-、NO3-可以大量共存 | |
| D. | 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol O2完全反应时,转移的电子数为0.4NA | |
| B. | 用惰性电极点解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| D. | 1mol 葡萄糖与足量的钠反应能产生2.5mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液 | |
| B. | 某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 | |
| C. | 用过滤法无法除去Fe(OH)3胶体中的FeCl3 | |
| D. | 升高温度纯水的离子积增大,但pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com