
【题目】已知阿伏加德罗常数和一个水分子的质量、一个水分子的体积,不能确定的物理量有
A. 1摩尔水的质量B. 1摩尔水蒸气的质量
C. 1摩尔水的体积D. 1摩尔水蒸气的体积
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D
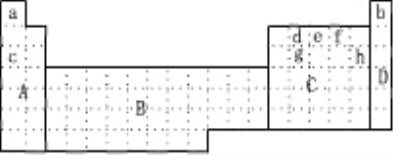
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________(填名称),可以验证该结论的实验是_______。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________(用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与氧化还原反应无关的是
A. 铜质器皿上出现铜绿[Cu2(OH)2CO3] B. 铝表面生成致密的保护膜
C. 大理石雕像被酸腐蚀毁坏 D. 钠露置空气中表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
(1)以黄铁矿为原料生产SO2时反应的化学方程式为: , 该反应在中进行(填设备名称);
(2)某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是;
压强(Pa) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
500 | 96.75% | 97.67% | 98.52% | 98.94% |
600 | 85.20% | 88.97% | 92.76% | 94.68% |
(3)接触室内有一热交换器,其作用是 , 若将从C处(如图)出来的气体通入BaCl2溶液中,则主要负电离子方程式为(写总反应式);
(4)下列做法中,与提高硫酸工业的经济效益无关的是;a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)、;
②将尾气中SO2在一定条件下转化为CaSO4 , 然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式;
(6)若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种重要的高分子酯,其合成线路如图1所示,其中A是苯的同系物,1molA与1mol苯分别完全燃烧时,A比苯多消耗3molO2 , A的核磁共振氢谱有3组峰;B与X互为同分异构体;1molC发生银镜反应时最多可得到4molAg.
已知:(如图2所示)
(1)A的名称是 , 1molB最多消耗molNaOH;
(2)出现X的结构简式 , C中官能团的名称是;
(3)D→E的化学方程式为;
(4)D有多种同分异构体,其中符合下列条件的同分异构体(不考虑立体异构)的有种,写出其中核磁共振氢谱有5组峰的结构简式;
①能与浓溴水发生取代反应;②能发生水解反应.
(5)以C和乙烯为基本原料,经如图3所示变化可得到一种用途广泛的酯类增塑剂G:
①试剂I是;
②工业上发生I的试剂与条件是;
③若生成G的反应中,消耗掉的H与F物质的量之比为1:2,则G的分子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:
(1)已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1025kJmol﹣1②N2(g)+O2(g)2NO(g)△H=+180.5kJmol﹣1
水的汽化热△H=+44kJmol﹣1
据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式;
(2)工业时合成氨的原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 . 图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为 , 曲线与曲线对应的压强P1P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简).下列各项中能说明反应已达到平衡状态的是 . a.混合气体的平均相对分子质量不变 b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变 d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3 , 其总反应是8NO+7H2═3NH4NO3+2HNO3 , 试写出以惰性材料作电极的阴极反应式: . 电解过程中为使电解产物全部转化为NH4NO3 , 需要补充NH3的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”。关于月光穿过薄雾所形成的种种美景的说法不正确的是
A. 空气中的小水滴颗粒大小约为10﹣9m~10﹣7mB. 光是一种胶体
C. 雾是一种胶体D. 发生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com