
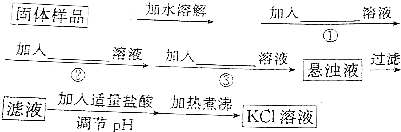
分析 将混有K2SO4、MgSO4的KCl固体提纯的流程为,先将固体配制成溶液,除去SO42-、Mg2+离子的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的BaCl2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入BaCl2溶液,后加入K2CO3溶液,同时要注意不可加入Ba(NO3)2、Na2CO3和NaOH溶液进行除杂,也不可用稀盐酸调节溶液的pH,否则会引进Na+和NO3-杂质,以此解答该题.
解答 解:将混有K2SO4、MgSO4的KCl固体提纯的流程为,先将固体配制成溶液,除去SO42-、Mg2+离子的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的BaCl2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入BaCl2溶液,后加入K2CO3溶液,同时要注意不可加入Ba(NO3)2、Na2CO3和NaOH溶液进行除杂,也不可用稀盐酸调节溶液的pH,否则会引进Na+和NO3-杂质,
(1)溶解时,可用玻璃棒搅拌,故答案为:搅拌;
(2)先加氢氧化钾,除去镁离子,再加氯化钡,除去硫酸根,再加碳酸钾,除去多余的钡离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾,所以试剂①为KOH,试剂③为K2CO3,
故答案为:KOH、BaCl2、K2CO3;
(3)加入过量硝酸钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴Ba(NO3)2溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:静置,取少量上层澄清溶液,再加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽;
(4)为简化实验操作,可一次性过滤,如果多次过滤会使过程复杂化,则不需要多次过滤,
故答案为:不需要;生成的沉淀可一次性过滤,如果多次过滤会使过程复杂化;
(5)步骤2的最终的沉淀会附着氯化钾等物质,取最后的洗涤液,检验溶液是否含有氯离子,检验方法为:取最后一次洗涤液少许于试管中,滴加AgNO3溶液,若无沉淀产生,则已洗净,
故答案为:取最后一次洗涤液少许于试管中,滴加AgNO3溶液,若无沉淀产生,则已洗净.
点评 本题考查混合物的分离提纯的综合应用,为高频考点,侧重于学生的分析能力、实验能力的考查,把握流程中的反应、混合物分离方法选择为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | +283.5 kJ•mol-1 | B. | -172.5 kJ•mol-1 | C. | +172.5 kJ•mol-1 | D. | -504 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | 只有①② | C. | 只有①②③ | D. | 只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O═2HCO3ˉ+SO32- | |
| B. | 金属铝溶于盐酸中 Al+2H+═Al3++H2↑ | |
| C. | 硫化钠溶于水 S2-+H2O═H2S↑+2OH- | |
| D. | 碳酸镁溶于硝酸中 CO32ˉ+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| B. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| C. | 强酸性溶液中:Fe3+、K+、SCN-、SO42- | |
| D. | 石蕊试液呈紫色的溶液中:NH4+、Al3+、NO3-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com