
����Ŀ����1����֪����ӦFe(s)��CO2(g)![]() FeO(s)��CO(g)��ƽ�ⳣ��ΪK1����ӦFe(s)��H2O(g)
FeO(s)��CO(g)��ƽ�ⳣ��ΪK1����ӦFe(s)��H2O(g)![]() FeO(s)��H2(g)��ƽ�ⳣ��ΪK2����ͬ�¶�ʱK1��K2��ֵ���±���
FeO(s)��H2(g)��ƽ�ⳣ��ΪK2����ͬ�¶�ʱK1��K2��ֵ���±���
�¶�/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
����ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)��ƽ�ⳣ��K�ɱ�ʾΪK��__(��K1��K2����ʾ)
CO(g)��H2O(g)��ƽ�ⳣ��K�ɱ�ʾΪK��__(��K1��K2����ʾ)
�ڸ��ݱ������ݣ�����֪�÷�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)��__(��������������������)��Ӧ��
CO(g)��H2O(g)��__(��������������������)��Ӧ��
��2����֪���¶�ΪTʱ��CO(g)��H2O(g)![]() CO2(g)��H2(g)��ƽ�ⳣ��K��0.32���ڸ��¶��£���֪cʼ(CO)��1mol��L��1��cʼ(H2O)��1mol��L��1��ijʱ�̾��ⶨCO��ת����Ϊ20%�����ʱ�÷�Ӧ__(�����ﵽƽ�������������ƶ����������ƶ���)��������__(ͨ������˵������)��
CO2(g)��H2(g)��ƽ�ⳣ��K��0.32���ڸ��¶��£���֪cʼ(CO)��1mol��L��1��cʼ(H2O)��1mol��L��1��ijʱ�̾��ⶨCO��ת����Ϊ20%�����ʱ�÷�Ӧ__(�����ﵽƽ�������������ƶ����������ƶ���)��������__(ͨ������˵������)��
��3�����ݻ�ΪVL�������г���amolCO��2amolH2���ڴ��������·�Ӧ���ɼ״���ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��

��p1__(��������������������������)p2��
���������������������£�������amolCO��2amolH2���ﵽ��ƽ��ʱ��CO��ת����__(��������������С����������������ͬ)��ƽ�ⳣ��__��
���𰸡�![]() ���� �����ƶ� ��ʱQc=
���� �����ƶ� ��ʱQc= ��
��![]() =0.0625��0.32 �� ���� ����
=0.0625��0.32 �� ���� ����
��������
�ɱ������ݿ�֪���¶����ߣ���Ӧ��Fe(s)��CO2(g)![]() FeO(s)��CO(g)��ƽ�ⳣ������˵��ƽ��������Ӧ�����ƶ���������Ӧ���ȣ���Ӧ��Fe(s)��H2O(g)
FeO(s)��CO(g)��ƽ�ⳣ������˵��ƽ��������Ӧ�����ƶ���������Ӧ���ȣ���Ӧ��Fe(s)��H2O(g)![]() FeO(s)��H2(g) ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���������Ӧ���ȡ�
FeO(s)��H2(g) ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���������Ӧ���ȡ�
��ͬ�¶��£�ͬһ�����У�����ѹǿ��ƽ��������Ӧ�����ƶ�����CO��ת���������¶��ݻ����䣬����ܱ�����������a mol CO�� 2a mol H2����ЧΪ��ʼ����2a mol CO�� 4a mol H2���������1����ƽ�������ѹǿ����ѹ���ָ���ԭ�����������ѹǿƽ���������С�ķ����ƶ���ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬���ݴ˷������
��1����֪��Ӧ��Fe(s)��CO2(g)![]() FeO(s)��CO(g)��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)��H2O(g)
FeO(s)��CO(g)��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)��H2O(g)![]() FeO(s)��H2(g)��ƽ�ⳣ��ΪK2�����ݸ�˹���ɢ�-�ڵ�CO2(g)��H2(g)
FeO(s)��H2(g)��ƽ�ⳣ��ΪK2�����ݸ�˹���ɢ�-�ڵ�CO2(g)��H2(g)![]() CO(g)��H2O(g)����ƽ�ⳣ��K�ɱ�ʾΪK��
CO(g)��H2O(g)����ƽ�ⳣ��K�ɱ�ʾΪK��![]() ��������ɵ�973KʱK3=1.47��2.38=0.62��1173KʱK3=2.15��1.67=1.29�������¶ȵ�����ƽ��������Ӧ�����ƶ�������Ӧ���ȡ�
��������ɵ�973KʱK3=1.47��2.38=0.62��1173KʱK3=2.15��1.67=1.29�������¶ȵ�����ƽ��������Ӧ�����ƶ�������Ӧ���ȡ�
�ʴ�Ϊ![]() ���ȡ�
���ȡ�
��2����֪cʼ(CO)��1mol��L��1��cʼ(H2O)��1mol��L��1��ijʱ�̾��ⶨCO��ת����Ϊ20%�����ʱ�÷�ӦQc= ��
��![]() =0.0625��0.32��Qc��Kʱ��Ӧ������Ӧ������С�
=0.0625��0.32��Qc��Kʱ��Ӧ������Ӧ������С�
�ʴ�Ϊ�������ƶ� Qc= ��
��![]() =0.0625��0.32
=0.0625��0.32
��3������ͬ�¶��£�ͬһ�����У�����ѹǿ��ƽ��������Ӧ�����ƶ�����CO��ת����������ͼ��֪��p1С��p2��
���¶��ݻ����䣬����ܱ�����������a mol CO�� 2a mol H2����ЧΪ��ʼ����2a mol CO�� 4a mol H2���������1����ƽ�������ѹǿ����ѹ���ָ���ԭ�����������ѹǿƽ���������С�ķ����ƶ����÷�ӦΪ���������С�ķ�Ӧ����������Ӧ�ƶ���COת��������ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䡣
�ʴ�Ϊ��С�� ���� ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������20mL 0.2mol/L H2A��Һ�еμ�0.2mol/L NaOH��Һ���й��������ʵ����仯����ͼ(���Т����H2A�����HA-�����A2-)����ͼʾ�ж�����˵����ȷ����( )
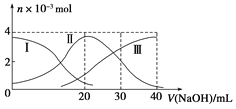
A.H2A��ˮ�еĵ��뷽��ʽ�ǣ�H2A=H+��HA-��HA-H+��A2-
B.��V(NaOH)��20mLʱ��Һ�и�����Ũ�ȵĴ�С˳��Ϊ��c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.�������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
D.��V(NaOH)��30mLʱ����Һ�д������¹�ϵ��2c(H+)��c(HA-)��2c(H2A)��c(A2-)��2c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ŵ����(Grenoble)Լɪ��������Ҷ��ѧ���о�С�鷢���˵�һ���ֲ������Ϊ���������ṩ���ܵ�����������ȼ�ϵ�أ������ԭ���������Ǻ�������������ø�������·�����Ӧ��C6H12O6��6O2![]() 6CO2��6H2O(���Ի���)�������йظõ�ص�˵������ȷ����(����)
6CO2��6H2O(���Ի���)�������йظõ�ص�˵������ȷ����(����)
A. ������ȼ�ϵ�ز������ڸ����¹���
B. ��صĸ�����ӦΪC6H12O6��6H2O��24e��=6CO2����24H��
C. ����1 mol����ʱת��4 mol e����H�����ƶ�
D. �����о��������跨�������������ȼ�ϵ�ص�Ч�ʣ��Ӷ�ʹ���ڽ�������Ϊ�κο�ֲ��ҽ���豸�ṩ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ���������ȷ����
A. NaHS�ĵ��룺NaHS = Na+ + H+ + S2��
B. �ѽ���������ϡ�����У� Fe + 2H+ = Fe2+ + H2��
C. NaHCO3��Һ�������ij���ʯ��ˮ��Ӧ��HCO3�� + OH�� + Ca2+ = CaCO3��+ H2O
D. HClO�ĵ��룺HClO ![]() H+ + ClO��
H+ + ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�У���������ˮ�������ɵ�H+Ũ��֮��(�٣��ڣ��ۣ���)��(����)
��pH=0������ ��0.1molL��1������ ��0.01molL��1��NaOH��Һ��pH=11��NaOH��Һ��
A.1��10��100��1 000B.0��1��12��11
C.14��13��12��11D.14��13��2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��B��C��D��E��F����Ԫ�غ˵��������������Ԫ�����ڱ���ǰ�����ڵ�Ԫ�ء�����Aԭ�Ӻ���������δ�ɶԵ��ӣ�B��E���γ����ӻ�����B2E��Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�D���ʵ��۵���ͬ����Ԫ���γɵĵ���������ߵģ�Fԭ�Ӻ���������������B��ͬ���������������������������Ϣ���ش��������⣺
��A��B��C��D�ĵ�һ��������С�����˳��Ϊ________����Ԫ�ط��ű�ʾ����
��E��D��ͬ�������Ԫ�ؿ��γ�һ�ֻ�����X��X�dz������л��ܼ���X���ӵĿռ乹����________��
��Fԭ�ӵĺ�������Ų�ʽ��____________��F�ĸ�������A�ļ��⻯���γɵ������ӵĻ�ѧʽΪ________��
��A��F�γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ�����仯ѧʽΪ________����ɫ���ʾFԭ�ӣ���
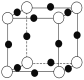
��A��C�γɵĻ�������и߷е��Ӳ�ȣ���һ���������ǽ������ϣ��侧���������Ļ�ѧ������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ���仯�����ڹ�ũҵ������Ӧ�ù㷺��
��1���ڳ�ʪ�����У����������绯ѧ��ʴת��ΪFe(OH)2�ķ�Ӧ����ʽΪ_______���ں��е�Ũ��������Һ������װ���У�����ʴ�������ɿ쵽����˳����____________���������д����

��2����֪����3Fe��s��+2O2��g��=Fe3O4��s��![]() H=-1118 kJ��mol-1
H=-1118 kJ��mol-1
��2Al��s��+3/2O2��g��=A12O3��s��![]() H=-1675.7 kJ��mol-1
H=-1675.7 kJ��mol-1
�Ӹֹ�ʱ����Fe3O4������Ӧ��������Al2O3���Ȼ�ѧ����ʽΪ______________��
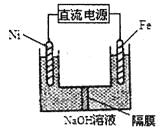
��3��Na2FeO4����ǿ�����ԣ������Ʒ���ͼ��ʾ����д�������ĵ缫��Ӧʽ______��Na2FeO4��һ�ּ���ɱ��������������������ˮ��ˮ����������ԭ����______________��
��4����ҵ�ϳ���FeCl3��Һ��ʴӡˢ��·�壬������Ӧ�����ӷ���ʽ��____________������ʴͭ������Һ�У�Cu2+��Fe3+��Fe2+Ũ�Ⱦ�Ϊ0��1 mol��L-1�������ͼ�������������Һ��ͨ�백��������Һ��pH=5��6ʱ����Һ�д��ڵĽ���������Ϊ____����ͼ�����ݼ���Fe(OH)2���ܶȻ�Ksp[Fe(OH)2]=______��
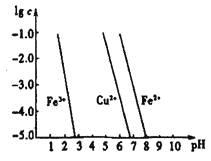
��֪��������Ϊ��Һ��pH��������Ϊ�������ӵ����ʵ���Ũ�ȵĶ���������Һ�н�������Ũ��![]() 10-5mol��L-1ʱ������Ϊ������ȫ����
10-5mol��L-1ʱ������Ϊ������ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶������ݻ�Ϊ2 L���ܱ������ڽ���ijһ��Ӧ������������X������Y�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ����ͼ��֪
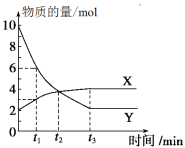
A. ��Ӧ�Ļ�ѧ����ʽΪ4Y=X
B. ��Ӧ���е�t1ʱ��Y��Ũ�ȼ�����3 mol��L��1
C. ��Ӧ���е�t2ʱ���ﵽƽ��״̬
D. ��Ӧ���е�t3ʱ��ÿ����4 mol Y��ͬʱ����1 mol X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ܸ�AB���˷ֱ���������ͬ��������ͬ�Ŀ���ͭ��Ϳ��������ڸܸ�ʹ����ˮ�б���ƽ�⣬Ȼ��С�ĵ����ձ��������ŨCuSO4��Һ��һ��ʱ��������йظܸ˵�ƫ���ж���ȷ����(ʵ������в�������˿��Ӧ�����߸����ı仯) �� ��

A. �ܸ�Ϊ����;�Ե��ʱ����ΪA�˸�B�˵�
B. �ܸ�Ϊ����;�Ե��ʱ����ΪA�˵�B�˸�
C. ���ܸ�Ϊ��Ե��ʱ��A�˵�B�˸ߣ�Ϊ����ʱ��A�˸�B�˵�
D. ���ܸ�Ϊ��Ե��ʱ��A�˸�B�˵ͣ�Ϊ����ʱ��A�˵�B�˸�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com