
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5molL﹣1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】解:A.H2S为二元弱酸,分步电离,第一步电离程度远远大于第二步,所以溶液中c(H+)>c(HS﹣),故A错误;B.加水稀释促进一水合氨电离,pH=a的氨水溶液,稀释10倍后,溶液中的氢氧根离子浓度大于原来的 ![]() ,其pH=b,则a<b+1,故B错误;
,其pH=b,则a<b+1,故B错误;
C.H2C2O4是二元弱酸,任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)+2c(C2O42﹣),故C错误;
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液,酸根离子水解程度越小,其浓度越大,酸根离子水解程度 ①<②<③,所以盐浓度 ①>②>③,钠离子不水解,所以c(Na+):①>②>③,故D正确;
故选D.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】用铂电极电解某金属的硫酸盐(XSO4)溶液,当阳极上收集到1.12L气体(标准状况,忽略气体溶解)时,阴极质量增加6.4g,下列判断不正确的是( )
A. 电路中有0.1mol电子通过
B. 该金属是Cu
C. 电解后溶液的pH降低
D. 向电解后的溶液中加入0.1molCuO可使溶液恢复电解前的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N的质量数为14,在粒子NH3T+中,电子数、质子数、中子数之比为
A. 10∶7∶11B. 10∶11∶8C. 10∶11∶9D. 11∶9∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________________________。
(2)烧杯间填满碎纸条的作用是________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)如果用50mL0.50mol/L硝酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH﹣Ni电池),下列有关说法中不正确的是( ) 
A.放电时正极反应为:NiOOH+H2O+e﹣→Ni(OH)2+OH﹣
B.电池的电解液可为KOH溶液
C.充电时负极反应为:MH+OH﹣→H2O+M+e﹣
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题.
(1)流程甲加入盐酸后生成Al3+的离子方程式为 .
(2)流程乙加入烧碱后生成SiO ![]() 的离子方程式为 .
的离子方程式为 .
(3)验证滤液B含Fe3+ , 可取少量滤液并加入(填试剂名称)
(4)滤液E、K中溶质的主要成分是(填化学式),写出该溶质的一种用途. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.汽油和花生油的主要成分都是油脂
B.油脂在酸性条件下的水解反应叫皂化反应
C.乙酸乙酯、油脂与NaOH溶液反应均有醇生成
D.油脂难溶于水,属天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列 有关R,W,X,Y,Z 5种元素的叙述中,正确的是( ) 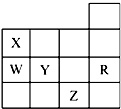
A.常压下5种元素的单质中Z单质的沸 点最高
B.Y,Z的阴离子电子层结构都与R原子的相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物的还原性比Y的氢化物的还原性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH ="-92.4" kJmol-1,下列关于该反应的说法正确的是
2NH3(g)ΔH ="-92.4" kJmol-1,下列关于该反应的说法正确的是
A. 反应达到平衡时共放出46.2 kJ的热量
B. 若将容器体积压缩至0.5L,可提高单位体积内活化分子百分数,从而加快正反应速率,降低逆反应速率
C. 任何时刻均有:υ(N2)=3υ(H2)=2υ(NH3)
D. 若保持容器体积不变,继续通入0.5mol N2和1.5mol H2,则N2的转化率变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com