
A、 Zn、MnO2干电池放电时MnO2被氧化 Zn、MnO2干电池放电时MnO2被氧化 |
B、 电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 |
C、 K分别于M、N连接,均可保护Fe电极,且都称为“牺牲阳极的阴极保护法” K分别于M、N连接,均可保护Fe电极,且都称为“牺牲阳极的阴极保护法” |
D、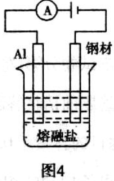 在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl3-,形式存在,则阳极反应式为:Al-3e-+7AlCl4-=4Al2Cl3- 在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl3-,形式存在,则阳极反应式为:Al-3e-+7AlCl4-=4Al2Cl3- |


科目:高中化学 来源: 题型:
| A、每个水分子内含有两个氢键 |
| B、在水蒸气、水和冰中都含有氢键 |
| C、HF的稳定性很强,是因为其分子间能形成氢键 |
| D、分子间能形成氢键使物质的熔点和沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的性质随着原子的相对质量的递增而呈周期性变化的规律叫做元素周期律 |
| B、X2+的核外电子数目为18,则X在第三周期第ⅥA族 |
| C、因K比Na容易失去电子,所以金属性K比Na强 |
| D、Li、Na、K元素的原子随着核电荷数的增加核外电子层数减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能生成碱的金属元素都在 IA族 |
| B、稀有气体元素原子的最外层电子数均为8 |
| C、第二周期 VIA族元素的原子核电荷数和中子数一定为8 |
| D、原子序数为14的元素位于元素周期表的第3周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


 的名称为_
的名称为_查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂是高分子化台物,水解可生成甘油和高级脂肪酸 |
| B、葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
| C、煤中含有的煤焦油,可由煤干馏获得 |
| D、聚乙烯塑料的老化是因为发生了加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com