
| A. | 加水,SO3-浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HSO3-浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HSO3-浓度减小 |
分析 A.加水稀释平衡状态下微粒浓度减小;
B.氯气具有氧化性能氧化亚硫酸为硫酸,溶液中氢离子浓度增大;
C.加入CaSO3粉末为不溶固体,在溶液中存在沉淀溶解平衡,亚硫酸根离子浓度增大;
D.通入HCl气体,氢离子浓度增大,HSO3-离子浓度减小.
解答 解:A.加水稀释平衡状态下微粒浓度减小,加水,SO32-浓度减小,故A错误;
B.氯气具有氧化性能氧化亚硫酸为硫酸,溶液中氢离子浓度增大,溶液PH减小,故B错误;
C.加入CaSO3粉末为不溶固体,在溶液中存在沉淀溶解平衡,亚硫酸根离子浓度增大,第二个平衡平衡逆向进行亚硫酸根离子浓度增大,故C错误;
D.通入HCl气体,氢离子浓度增大,第一步电离平衡逆向进行HSO3-离子浓度减小,故D正确;
故选D.
点评 本题考查了二氧化硫性质,弱电解质电离平衡的影响因素分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 晶体硅没有固定的熔沸点 | |
| B. | 形成晶体硅的速率越快越好 | |
| C. | 可用于X-射线衍射实验来鉴别晶体硅和玻璃 | |
| D. | 晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
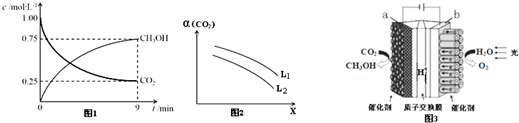
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出CO2的电子式
,写出CO2的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若原料完全反应生成上述产物,CH2CH2Br与NH3的物质之比为2:1 | |
| B. | 该反应属于取代反应 | |
| C. | CH2CH2Br与HBr均属于电解质 | |
| D. | CH2CH2Br难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制480 mL 0.1 mol/L NaOH溶液,需要准确称量NaOH 1.920 g | |
| B. | 学生实验测定硫酸铜晶体中结晶水含量时,通常至少称量4次 | |
| C. | 酸碱中和滴定实验中只能用标准液滴定待测液 | |
| D. | 分液时,分液漏斗中下层液体从下口放出后,换一容器再从下口放出上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
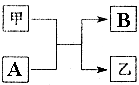 单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:
单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com