
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=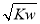 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:选择题
下列化合物①NaHCO3,②Al(OH)3,③AlCI3,④H2N﹣CH2﹣COOH,⑤Na2CO3跟盐酸和氢氧化钠溶液都能反应的是
A.②③④ B.①②④ C.Z①②③ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:填空题
下图中A、B、C、D、E、F、G均为有机化合物。
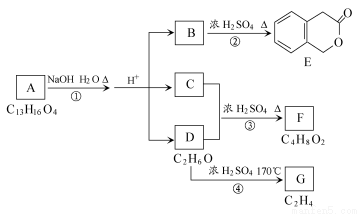
根据上图回答问题:
(1)D的化学名称是________________________。
(2)反应③的化学方程式是________________________________。(有机物须用结构简式表示)
(3)B的分子式是__________________________。
(4)反应①的反应类型是__________________。A的结构简式是_______。
(5)符合下列3个条件的B的同分异构体的数目有____________个。
①含有邻二取代苯环结构;②与B有相同的官能团;③不与FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式________________。
(6)G的重要的工业原料,用化学方程式表示G的一种重要的工业用途________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:选择题
下列说法错误的是( )
A.乙醇和乙酸都可以由玉米等含糖类物质制取
B.煤的气化可以得到水煤气
C.鸡蛋清中加入CuSO4溶液产生盐析
D.石油分馏可获得汽油、煤油和柴油
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:填空题
醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:
反应 | 乙醇(mol) | 乙酸(mol) | 乙酸乙酯(mol) |
1 | 2 | 2 | 1.33 |
2 | 3 | 2 | 1.57 |
3 | 4 | 2 | x |
4 | 5 | 2 | 1.76 |
由表中数据推测,数值x的范围是________。
(2)现有25°C时,pH=3的醋酸。请回答以下问题:
①若向醋酸中加入少量醋酸钠固体,此时溶液中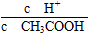 将________(填“增大”“减小”或“不变”);
将________(填“增大”“减小”或“不变”);
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH________7(填“>”“<”或“=”);
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:填空题
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl溶液与0.04 mol·L-1的NaHA溶液等体积混合
④0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHA溶液等体积混合
下列关于上述四种溶液的说法不正确的是( )
A.溶液②中存在水解平衡:HA-+H2O H2A+OH-
H2A+OH-
B.溶液③中有:c(HA-)+c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c(HA-)大小:③>①>②>④
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g) 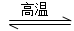 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率为________mol/(L·min);该反应的平衡常数表达式K=________。
(2)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是________。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比________m/n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s 的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0 mol Cl2,达到平衡时,PCl3 的转化率大于80%
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.氢键、分子间作用力、离子键、共价键都是微粒间的作用力。其中分子间作用力只影响物质的熔沸点而不影响物质的溶解性。
B.石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向。
C.H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象。
D.原子结构模型的演变经历了:
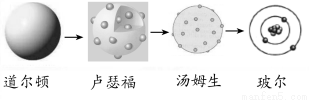
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com