
| ���� | ���� | ���� |
| �� | ��2mL 1 mol��L-1FeCl3��Һ�м���һ������Na2SO3��Һ | ��Һ���ػ�ɫ��Ϊ���ɫ�����������̼�����ζ�������ݳ� |
| ���� | ���� | ���� |
| �� | �ü�������䲽��I�еĺ��ɫ��Һ | ���֡������ЧӦ�� |
| ���� | ���� | ���� |
| �� | ��1 mol?L-1��FeCl3��Һ��ͨ��һ������SO2 | ��Һ�ɻ�ɫ��Ϊ���ɫ |
| �� | �ü�������䲽����еĺ��ɫ��Һ | û�г��֡������ЧӦ�� |
 Fe(OH)3+3H+������Na2SO3��c(H+)�½���ƽ�������ƶ�������Fe(OH)3�����ӷ���ʽ1�֣�ƽ���ƶ�����1�֣���2�֣�
Fe(OH)3+3H+������Na2SO3��c(H+)�½���ƽ�������ƶ�������Fe(OH)3�����ӷ���ʽ1�֣�ƽ���ƶ�����1�֣���2�֣� Fe(OH)3+3H+������Na2SO3�����������ӣ���Һ��c(H+)�½���ƽ�������ƶ�������Fe(OH)3��
Fe(OH)3+3H+������Na2SO3�����������ӣ���Һ��c(H+)�½���ƽ�������ƶ�������Fe(OH)3��

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| ������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| ��ʼ���� | 1.3 | 3.3 | 7.5 | 10.3 |
| ��ȫ���� | 2.8 | 5.2 | 9.7 | 12.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
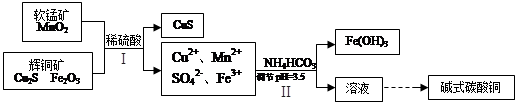
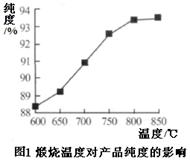
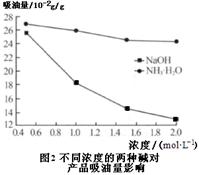
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
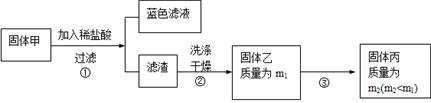
 ԭ�������������������ȼ��̶�װ��ʡ�ԣ��Ʊ����������CO������CO��ԭCuO��ĩ��
ԭ�������������������ȼ��̶�װ��ʡ�ԣ��Ʊ����������CO������CO��ԭCuO��ĩ��
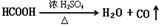
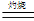 2 Cu2O + O2������ Cu2O +2H+
2 Cu2O + O2������ Cu2O +2H+�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
|
 ��3�� �������ڿ���������ʱ��ʹ�õ�ʵ���������˲����������żܡ��ƾ����⣬�������У� ��
��3�� �������ڿ���������ʱ��ʹ�õ�ʵ���������˲����������żܡ��ƾ����⣬�������У� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������������ͭ�����ʵ���Ϊ0.025 mol |
| B�����������Cu�����ʵ���Ϊ0.005 mol��������Cu2O��CuO�����ʵ�����0.020 mol |
| C����������к�0.01 mol Cu��������Cu2O��CuO�����ʵ�����Ϊ0.005 mol |
| D���������Cu�����ʵ�����ȡֵ��ΧΪ0.005 mol<n(Cu)<0.015 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ͭ˿����Ũ�����м��ȣ���Ӧ���ˮ���뷴Ӧ���У��۲�����ͭ��Һ����ɫ |
| B�������½�ͭ˿����ʢ�������ļ���ƿ�У��۲�CuCl2������ |
| C����CuCl2��Һ���������м������ɣ��õ���ˮCuCl2���� |
| D����������ͭ��[Cu2(OH)2CO3]��ͭ�����������н��ݣ���ȥͭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��6.4 g | B��4.8 g | C��2.4 g | D��1.6 g |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com