
分析 (1)含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,还原剂对应的产物为氧化产物;
(2)根据C、Cl元素的化合价变化来分析,化合价升高的元素原子失去电子,化合价降低的元素的原子得到电子,化合价升高值=化合价降低值=转移电子数,根据电子守恒来配平;
(3)结合化学方程式来计算被氧化的还原剂的物质的量.
解答 解:(1)Cl元素的化合价降低,C元素的化合价升高,则Cl2为氧化剂,C为还原剂,CO是氧化产物,
故答案为:Cl2;CO;
(2)在反应中,C元素的化合价由0升高到+2价,失电子数目是2,Cl元素的化合价由0降低为-1价,得到电子数目共为2,Cl元素守恒,所以氯气前边系数是2,根据电子守恒,碳单质和一氧化碳前边系数都是2,根据钛元素守恒,所以二氧化钛前边系数是1,方程式为:TiO2+2C+2Cl2═TiCl4+2CO,电子转移情况如下: ,故答案为:
,故答案为: ;
;
(3)根据化学方程式,当消耗2mol碳单质时,转移的电子为4mol,当有6mol电子转移,则有3mol还原剂C被氧化,故答案为:3.
点评 本题考查氧化还原反应,明确元素的化合价变化及原子守恒的方法来分析是解答本题的关键,并注意反应中化学计量数与转移电子数目的关系来解答即可.


科目:高中化学 来源: 题型:选择题
| A. | 通过质谱法只能确认化合物的相对分子质量,一般无法确定其结构 | |
| B. | 甲苯分子的核磁共振氢谱中有2个不同的吸收峰 | |
| C. | 红外光谱可以帮助确定许多有机物结构 | |
| D. | 某有机物完全燃烧只生成CO2和H2O,两者的物质的量之比为1:2,则该有机物可能为甲烷或甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
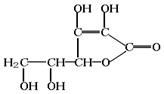
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
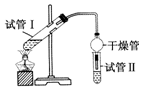 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当X是盐酸时,则F是稀硝酸24 | |
| B. | 当X是氢氧化钠时,则F是稀硝酸y | |
| C. | 当X是氢氧化钠时,B跟Cl2反应可能有白烟现象e | |
| D. | 当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积仅适用于纯水 | |
| B. | 水的电离需要直流电 | |
| C. | 升高温度水的离子积增大 | |
| D. | 加入电解质一定会破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<I2 | 氢化物沸点:HF<HCl<HBr<HI |
| B | 用电解熔融MgCl2可制得金属镁 | 用电解熔融NaCl也可以制取金属钠 |
| C | 将CO2通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al与S加热时直接化合生成Al2S3 | Fe与S加热时也能直接化合生成 Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com