
分析 酸性溶液的pH<7、中性溶液的pH=7、碱性溶液的pH>7,且酸性越强,溶液的pH越小,碱性越强,溶液的pH越大;先根据溶液酸碱性对各物质进行分类,然后根据电解质的电离,盐的水解程度大小判断溶液中氢离子、氢氧根离子浓度,再判断溶液pH大小.
解答 解:物质的量浓度均为0.2mol•L-1的六种溶液:①KOH ②HClO ③KCl ④NH4Cl ⑤HCl ⑥NaF,其中①KOH和⑥NaF显碱性,溶液的pH大于7;③KCl显中性,溶液的pH=7;而②HClO ④NH4Cl ⑤HCl均显酸性,溶液的pH均小于7.
而①KOH和⑥NaF,由于KOH是强碱,电离显碱性,而NaF是强碱弱酸盐,水解显碱性,故碱性①KOH>⑥NaF,故pH:⑥<①;
③KCl显中性,溶液的pH=7,故③<⑥<①;
而②HClO ④NH4Cl ⑤HCl均显酸性,而⑤HCl和②HClO 是电离显酸性,且HCl是强酸,能完全电离,HClO是弱酸,不能完全电离,故pH⑤HCl<②HClO,而
④NH4Cl 是水解显酸性,故pH⑤<②<④.
综上所述可知,溶液pH由小到大的顺序是⑤②④③⑥①.
故答案为:⑤②④③⑥①.
点评 本题考查了溶液PH的大小比较,题目难度不大,注意考虑电解质的强弱以及盐类的水解情况,试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 | |
| C. | O2和O3互为同位素 | |
| D. | O2和O3的相互转化不是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有Al(OH)3、Fe(OH)3沉淀析出 | |
| B. | 所得混合液中:$\frac{c(A{l}^{3+})}{c(F{e}^{3+})}$=3.25×104 | |
| C. | 所得混合液中相关微粒的浓度大小:c(Cu2+)=c(Al3+)>c(Fe3+)>c(H+) | |
| D. | 若向原溶液中逐滴加入NaOH溶液,最后析出的是Cu(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
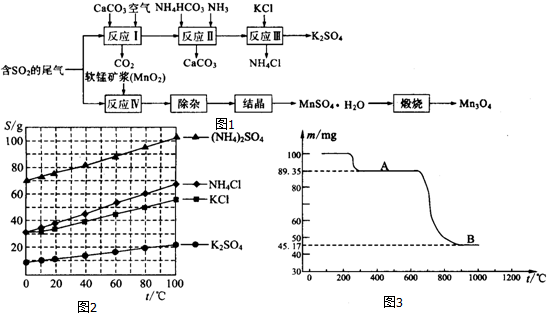
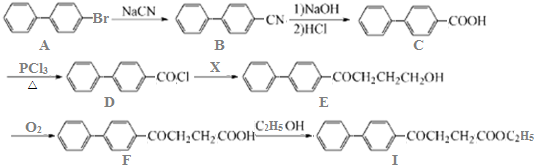
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
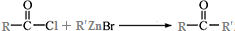
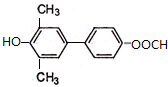 .
.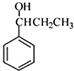 )为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
)为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com