
| A、SiCl4 |
| B、H2O |
| C、BF3 |
| D、PCl5 |


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的NaClO溶液中含ClO-的数目为NA |
| B、78 g 苯含有碳碳双键的数目为3NA |
| C、常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| D、标准状况下,2.24L Cl2与水充分反应转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
查看答案和解析>>
科目:高中化学 来源: 题型:
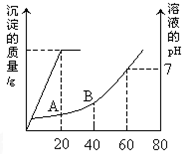 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=查看答案和解析>>
科目:高中化学 来源: 题型:
 有两只密闭容器A和B,A能保持恒压,B能保持恒容.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2?2SO3,并达到平衡.则(填>、=、<;左、右;增大、减小、不变).
有两只密闭容器A和B,A能保持恒压,B能保持恒容.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2?2SO3,并达到平衡.则(填>、=、<;左、右;增大、减小、不变).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.45 mol?L-1 |
| D、0.225 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示可逆反应A(g)+B(g)?nC(g)△H<0,在不同条件下反应混合物中C的质量分数C%和反应过程所需时间的关系曲线,有关叙述一定正确的是( )
如图表示可逆反应A(g)+B(g)?nC(g)△H<0,在不同条件下反应混合物中C的质量分数C%和反应过程所需时间的关系曲线,有关叙述一定正确的是( )| A、a表示有催化剂,而b无催化剂 |
| B、若其他条件相同,a比b的温度高 |
| C、若其他条件相同,a比b的压强大,n=l |
| D、反应由逆反应方向开始 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过品红溶液 |
| B、通过盐酸,再通过BaCl2溶液 |
| C、先通过NaOH溶液,再通过澄清石灰水 |
| D、先通过酸性KMnO4溶液,再通过澄清石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com