
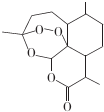
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可使酸性高锰酸钾溶液褪色 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 合金的硬度往往大于它的纯金属 | B. | 合金的熔点高于它的成分金属 | ||
| C. | 青铜是我国使用最早的合金 | D. | 钢是使用量最大,用途最广的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | NaOH和CO2 | C. | AlCl3和NaOH | D. | Na2O2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 和 H2在一定条件下反应生成NH3 | |
| B. | NO遇O2 转化为NO2 | |
| C. | 硝酸工厂用NH3 氧化制取NO | |
| D. | 由NH3 制取碳酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
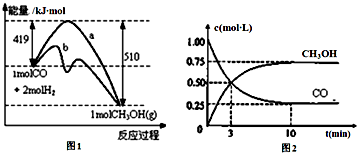 工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol
工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和铁 | B. | 镁和铜 | C. | 铝和镁 | D. | 锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
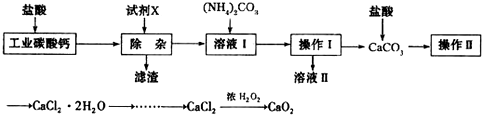
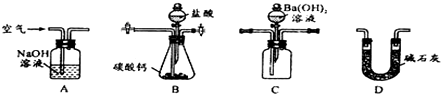
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com