
在标准状况下,下列气体含有的分子数最多的是 ( )
A.36.5g HCl B.22.4L O2 C.4g H2 D.0.5mol SO2
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol ,
氢氟酸的电离方程式及热效应可表示为________________________。
(2)将浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C.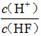 D.
D.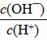
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
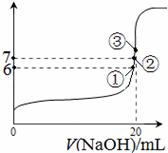 A.pH=3的HF溶液和pH=11的NaF溶液中,
A.pH=3的HF溶液和pH=11的NaF溶液中,
由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,
c(F—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F—)=c(Na+)
D.③点时V=20mL,此时溶液中c(F—)< c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液
③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(5)Na2CO3溶液显碱性是因为CO32—水解的缘故,请设计简单的实验事实证明之
___________________________________________ ________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1molHF转移 mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。求:
(1)原混合气体中甲烷的物质的量。
(2)原混合气体中氮气的体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于一个可逆反应mA+nB pC+qD,在一定温度下达到平衡,反应物浓度与生成物浓度符合下面的关系式=K,式中的K为常数。在密闭容器中将CO和水蒸气的混合气加热到800 ℃时,有下列平衡:CO(g)+H2O(g)
pC+qD,在一定温度下达到平衡,反应物浓度与生成物浓度符合下面的关系式=K,式中的K为常数。在密闭容器中将CO和水蒸气的混合气加热到800 ℃时,有下列平衡:CO(g)+H2O(g)  CO2(g)+H2(g),且K=1,若将2 mol CO和10 mol H2O(g)相互混合并加热到800 ℃,则CO的转化率约为 ( )。
CO2(g)+H2(g),且K=1,若将2 mol CO和10 mol H2O(g)相互混合并加热到800 ℃,则CO的转化率约为 ( )。
A.16.7% B.50%
C.66.7% D. 83.3%
83.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
要尽量除去杂质,加入的试剂必须稍过量,最后的过量物可以使用物理或化学方法除去。现要除去NaCl中少量的CaCl2、ZnCl2、Na2SO4杂质,下列选用试剂及其使用顺序正确的是 ( )
A.Na2CO3、BaCl2、HCl B.BaCl2、Na2CO3、H2SO4
C.BaCl2、Na2CO3、HCl D.Ba(NO3)2 、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式改写成化学方程式正确的是 ( )
A.Cu2++2OH-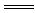 Cu(OH)2↓
Cu(OH)2↓
CuCO3+2NaOH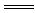 Cu(OH)2↓+Na2CO3
Cu(OH)2↓+Na2CO3
B.CO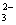 十2H+
十2H+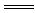 CO2↑十H2O
CO2↑十H2O
BaCO3+2HCl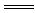 BaCl2+C02↑十H20
BaCl2+C02↑十H20
C.Ca2++CO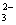
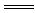 CaCO3↓
CaCO3↓
Ca(NO3)2+Na2CO3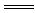 CaCO3↓+2NaNO3
CaCO3↓+2NaNO3
D.H++OH-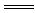 H20
H20
Ba(OH)2+H2SO4=BaSO4十2H20
查看答案和解析>>
科目:高中化学 来源: 题型:
制备晶体硅的热方程式为 SiHCl3(l)+H2(g)=Si(s)+3HCl(g) ΔH=+238KJ/mol,
已知SiHCl3(l)=SiHCl3(g) ΔH=+10KJ/mol,相关键能数据如下表:
| SiHCl3(g) Si—H | SiHCl3(g) Si—Cl | H2(g) H—H | HCl(g) H—Cl | |
| 键能(KJ/mol) | 377 | 360 | 436 | 431 |
则晶体硅的键能为
A.186KJ/mol B.181KJ/mol C.372KJ/mol D.362KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+H2O(g)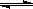 CO(g)+H2(g)在一可变容积的密闭容器内进行,达到平衡后,保持其他条件不变,下列条件的改变一定能使平衡移动的是
CO(g)+H2(g)在一可变容积的密闭容器内进行,达到平衡后,保持其他条件不变,下列条件的改变一定能使平衡移动的是
A.增加C的质量 B.保持体积不变,充入氦气使体系压强增大
C.加入催化剂 D.保持压强不变,充入氦气使容器体积增大
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com