
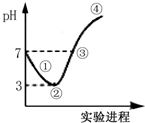
 ³£ĪĀĻĀ£¬½«Cl2»ŗ»ŗĶØČėĖ®ÖŠÖĮ±„ŗĶ£¬Č»ŗóĻņĖłµĆ±„ŗĶČÜŅŗÖŠµĪ¼Ó0.1mol•L-1 NaOHČÜŅŗ£¬Õūøö¹ż³ĢÖŠpHµÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ£Ø””””£©
³£ĪĀĻĀ£¬½«Cl2»ŗ»ŗĶØČėĖ®ÖŠÖĮ±„ŗĶ£¬Č»ŗóĻņĖłµĆ±„ŗĶČÜŅŗÖŠµĪ¼Ó0.1mol•L-1 NaOHČÜŅŗ£¬Õūøö¹ż³ĢÖŠpHµÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | “Ó·“Ó¦æŖŹ¼ÖĮ¢Śµć£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCl2+H2OØTClO-+2H++Cl- | |
| B£® | ¢Ū“¦±ķŹ¾ĀČĘųŗĶNaOHČÜŅŗĒ”ŗĆĶźČ«·“Ó¦ | |
| C£® | ¢ŚµćĖł±ķŹ¾µÄČÜŅŗÖŠĖł“ęŌŚµÄ¾ßÓŠŃõ»ÆŠŌµÄŗ¬ĀČŌŖĖŲµÄĪ¢Į£Ö÷ŅŖÓŠ£ŗCl2”¢HClO”¢ClO- | |
| D£® | “Ó·“Ó¦æŖŹ¼ÖĮ¢ŚµćæÉÓĆpHŹŌÖ½²ā¶ØČÜŅŗµÄpH |
·ÖĪö Õūøö¹ż³Ģ·¢ÉśµÄ·“Ó¦ĪŖCl2+H2O?HCl+HClO”¢HCl+NaOHØTNaCl+H2O”¢HClO+NaOHØTNaClO+H2O£¬¢ŁµćĖłŹ¾ČÜŅŗÖŠ·¢Éś·“Ó¦£ŗCl2+H2O?H++Cl-+HClO£¬¢ŚµćĖłŹ¾ČÜŅŗÖŠ·¢Éś·“Ó¦£ŗCl2+H2O?H++Cl-+HClO£¬HClOĪŖČõµē½āÖŹ£¬²æ·ÖµēĄė£¬ČÜŅŗÖŠ“ęŌŚµÄĮ£×ÓÓŠ£ŗH+”¢Cl-”¢ClO-”¢OH-£¬H2O”¢HClO”¢Cl2£¬¢ŪµćĖłŹ¾ČÜŅŗÖŠ·¢Éś·“Ó¦£ŗHCl+NaOHØTNaCl+H2O”¢HClO+NaOHØTNaClO+H2O£¬ČÜŅŗ³ŹÖŠŠŌ£¬Ōņc£ØH+£©=c£ØOH-£©£¬¢ÜµćČÜŅŗ³Ź¼īŠŌ£¬øł¾ŻČÜŅŗµÄĖį¼īŠŌ½įŗĻŃĪĄąĖ®½āµČÖŖŹ¶·ÖĪö½ā“š£®
½ā“š ½ā£ŗA£®HClOĪŖČõµē½āÖŹ£¬Ó¦Š“³É»ÆѧŹ½£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗCl2+H2O=H++Cl-+HClO£¬¹ŹA“ķĪó£»
B£®¢Ū“¦ČÜŅŗ³ŹÖŠŠŌ£¬Čē¹ūĀČĘųŗĶNaOHČÜŅŗĒ”ŗĆĶźČ«·“Ó¦£¬ČÜŅŗÖŠ“ęŌŚĀČ»ÆÄĘŗĶ“ĪĀČĖįÄĘ£¬“ĪĀČĖįÄĘĖ®½ā£¬ČÜŅŗÓ¦øĆĻŌ¼īŠŌ£¬¹ŹB“ķĪó£»
C£®¢ŚµćŹĒ±„ŗĶĀČĖ®£¬ĀČĖ®ÖŠ¾ßÓŠŃõ»ÆŠŌµÄŗ¬ĀČŌŖĖŲµÄĪ¢Į£Ö÷ŅŖÓŠ£ŗCl2”¢HClO”¢ClO-£¬¹ŹCÕżČ·£»
D£®ČÜŅŗÖŠŗ¬ÓŠ“ĪĀČĖį£¬¾ßÓŠĘư׊Ō£¬²»ÄÜÓĆpHŹŌÖ½²āĮ棬¹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éĮĖĀČĘųµÄŠŌÖŹ”¢»ÆѧĶ¼Ļó”¢ČÜŅŗµÄĖį¼īŠŌŗĶpHµÄĻą¹ŲÖŖŹ¶£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·ČÜŅŗÖŠµÄČÜÖŹ¼°ĘäŠŌÖŹŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢ŅāŃĪµÄĖ®½āŌĄķµÄÓ¦ÓĆ·½·Ø£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪöÄÜĮ¦¼°Įé»īÓ¦ÓĆÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | æĻ¶Ø²»“ęŌŚµÄĄė×ÓŹĒFe3+”¢Cu2+”¢NH4+”¢SO42-”¢CO32- | |
| B£® | æĻ¶Ø“ęŌŚµÄĄė×ÓŹĒNa+”¢K+”¢SO32-”¢Br- | |
| C£® | ĪŽ·ØČ·¶ØŌČÜŅŗÖŠŹĒ·ń“ęŌŚCl- | |
| D£® | Čō²½Öč¢ÜøÄÓĆBaCl2ČÜŅŗŗĶŃĪĖįµÄ»ģŗĻČÜŅŗ£¬Ōņ¶ŌČÜŅŗÖŠĄė×ÓµÄÅŠ¶ĻĪŽÓ°Ļģ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±½ŅŅĻ© 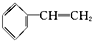 | B£® | ±½¼×Č© 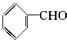 | C£® | ±½ŅŅĶŖ 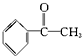 | D£® | ±½·Ó 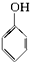 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4 L¼ŗĶéÖŠ¹²¼Ū¼üŹżÄæĪŖ19NA | |
| B£® | ³£ĪĀĻĀ£¬0.1 molŅŅĶéÓėŅŅĻ©»ģŗĻĘųĢåÖŠĖłŗ¬Ģ¼Ō×ÓŹżĪŖ0.2NA | |
| C£® | ŌŚ±ź×¼×“æöĻĀ£¬2.24 LĖÄĀČ¼×ĶéÖŠĖłŗ¬·Ö×ÓŹżĪŖ0.1NA | |
| D£® | 1 mol±½·Ö×ÓÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼üŹżĪŖ3 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1.7”Į10-3 mol/L | B£® | 1.9”Į10-4mol/L | C£® | 1.7”Į10-4mol/L | D£® | 5.7”Į10-5mol/L£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 84Ļū¶¾Ņŗŗ¬ÓŠ“ĪĀČĖįÄĘ£¬½ą²ŽĮéÖŠŗ¬ÓŠŃĪĖį£¬¶žÕß»ģŗĻŹ¹ÓĆ»į²śÉśĀČĘųŹ¹ČĖÖŠ¶¾ | |
| B£® | ŹäĖĶĀČĘųµÄ¹ÜµĄĀ©Ęų£¬æÉŅŌÓĆÅØ°±Ė®¼ģŃ飬ŹĒŅņĪŖĀČĘųŗĶ°±Ęų·¢Éś»ÆŗĻ·“Ӧɜ³ÉĀČ»Æļ§£® | |
| C£® | ŅņĀČĘųĻū¶¾¹żµÄ×ŌĄ“Ė®²»ŅĖÖ±½ÓÓĆĄ“Ńų½šÓć£¬×īŗĆŌŚŃō¹āĻĀɹŅ»¶ĪŹ±¼ä | |
| D£® | ĀČĘųŗĶ¶žŃõ»ÆĮņ¾łÓŠĘư׊Ō£¬¶žÕß°“Ģå»ż±Č1£ŗ1»ģŗĻŗó²»ÄÜŹĒÓŠÉ«²¼ĢõĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Įņ»ÆĒāŌŚŃõĘųÖŠČ¼ÉÕ | B£® | ĢśŌŚĮņÕōĘųÖŠ·“Ó¦ | ||
| C£® | ¶žŃõ»ÆĮņĶØČėŹÆ»ŅĖ® | D£® | ĮņŌŚŃõĘųÖŠČ¼ÉÕ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com