

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,:加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
分析 铜矿石溶于酸,然后采用过滤方法将难溶性固体和溶液分离,则操作I为过滤;然后向滤液中加入有机物采用萃取方法将含铜物质和溶液分离,所以操作II为萃取,得到的有机相中含有铜元素,再采用硫酸最萃取剂将含铜有机相萃取,得到硫酸铜溶液和有机相,将硫酸铜溶液加热浓缩、冷却结晶得到硫酸铜晶体,
(1)操作Ⅰ是酸溶后分离固体和溶液,操作是过滤;操作II是分离互不相溶的液体,实验操作是分液,
(2)依据操作II、操作III得到的物质和实验目的,浸出-萃取法制备硫酸铜,水相和有机相为了除去杂质;
(3)证明含有Cu4 ((OH)6SO4,可以证明硫酸根离子的存在设计实验验证;氢氧化铜的存在可以利用加热悬浊液氢氧化铜分解生成黑色的氧化铜沉淀分析回答;
(4)依据铜元素守恒结合物质的量计算晶体质量.
解答 解:铜矿石溶于酸,然后采用过滤方法将难溶性固体和溶液分离,则操作I为过滤;然后向滤液中加入有机物采用萃取方法将含铜物质和溶液分离,所以操作II为萃取,得到的有机相中含有铜元素,再采用硫酸最萃取剂将含铜有机相萃取,得到硫酸铜溶液和有机相,将硫酸铜溶液加热浓缩、冷却结晶得到硫酸铜晶体,
(1)依据流程图分析操作Ⅰ是矿石酸溶后分离固体和液体的方法,实验操作是过滤;操作Ⅱ是加入有机物溶解铜的化合物且能和水分层,实验操作是分液,用到的玻璃仪器有烧杯、分液漏斗等,故答案为:过滤;分液漏斗;
(2)利用水和有机溶剂萃取提纯硫酸铜溶液结晶得到硫酸铜晶体;操作II、操作III的主要目的是除去溶液中的杂质,故答案为:除杂;
(3)利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂 Cu2(0H)2C03悬浊液,由于条件控制不同使其中混有较多Cu(OH)2或Cu4(0H)6S04.实验验证杂质的存在,可以检验是否含硫酸根离子检验Cu4(0H)6S04的存在,加入盐酸排除其他离子的干扰,加入氯化钡生成白色沉淀证明含Cu4(0H)6S04;依据氢氧化铜受热分解生成氧化铜黑色沉淀设计实验来分析验证,取少量悬浊液于试管中利用沸水浴加热试管;试管中有黑色沉淀生成证明含Cu(OH)2;水浴加热的目的是避免温度过高氧化铜分解;
故答案为:步骤1:加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液;有白色沉淀生成;
步骤2:将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察;试管中有黑色固体生成;
(4)1OOmL O.5mol.L-1的CuSO4溶液中硫酸铜物质的量为0.05mol;配制时需称取CuSO4.5H2O 质量为12.5g,故答案为:12.5.
点评 本题考查物质制备,为高频考点,涉及物质成分检验、基本实验操作等知识点,明确反应原理是解本题关键,难点是(3)题实验方案设计,知道常见物质的性质及颜色,题目难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
 X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )| A. | 若 W 是单质铁,则 Z 溶液可能是 FeCl2 溶液 | |
| B. | 若 X 是碳酸钠,则 W 可能是盐酸 | |
| C. | 若 W 是氢氧化钠,则 X 与 Z 可反应生成 Y | |
| D. | 若 W 为氧气,则 Z 与水反应(或溶于水)一定生成一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
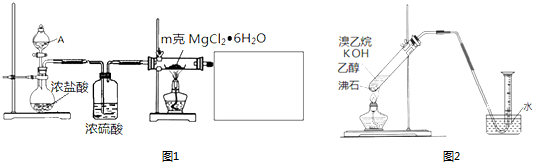
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| B. | 放电时负极反应为Zn+2e-+2OH-═Zn(OH)2 | |
| C. | 充电时阳极反应为Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
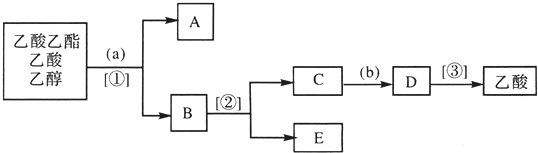
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化 | |
| B. | 乙烯和苯都能与H2发生加成反应,说明二者分子中所含碳碳键相同 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

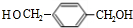 .上述反应中属于取代反应的是①②(填数字序号).
.上述反应中属于取代反应的是①②(填数字序号). +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaCl;
+2NaCl; +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$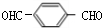 +2H2O.
+2H2O. .
.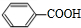 .
.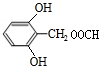 或
或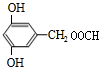 (写出一种).
(写出一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com