
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多卤代甲烷作为溶剂,其中分子结构为正四面体的是______________。工业上分离这些多卤代甲烷的方法是_______________________。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式_________________________(不考虑立体异构)。
(3)聚氯乙烯是生活中常见的塑料。工业生产聚氯乙烯的一种工艺路线如下:
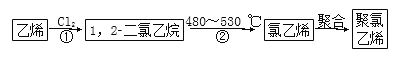
反应①的化学方程式是________________________,反应类型为____________,反应②的反应类型为____________。
【答案】(1)四氯化碳 分馏
(2)CF2BrCHFCl、CF2ClCHFBr、CFClBrCHF2
(3)H2C===CH2+Cl2→CH2ClCH2Cl 加成反应 消去反应
【解析】(1)甲烷是正四面体结构,若分子中的四个H原子全部被Cl原子取代得到CCl4,还是有极性键构成的非极性分子。由于这些多卤代甲烷都是分子晶体构成的物质,沸点不同,因此可采取分馏的方法分离。(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,其所有同分异构体的结构简式是CF2BrCHFCl、CF2ClCHFBr、CFClBrCHF2;(3)乙烯与氯气发生加成反应得到1,2二氯乙烷;反应①的化学方程式是H2C===CH2+Cl2→CH2ClCH2Cl。1,2二氯乙烷在480~530 ℃条件下发生消去反应得到氯乙烯CH2===CHCl,氯乙烯发生加聚反应得到聚氯乙烯。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】现代化学传感器技术是研究溶液中离子反应的重要手段,电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。如图是某同学用0.1 mol·L-1KOH溶液滴定体积均为20 mL、浓度均为0.1 mol·L-1的HCl溶液和CH3COOH溶液过程中溶液电导率变化示意图。
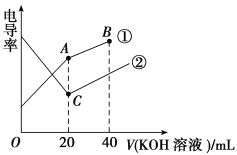
(1)曲线②代表0.1 mol·L-1KOH溶液滴定________溶液的滴定曲线。
(2)A点溶液的pH________(填“>”、“<”或“=”)C点溶液的pH。
(3)B点的溶液中离子浓度大小顺序是___________________________________。
(4)对照上述溶液电导率变化示意图,下列能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是________(填字母)。
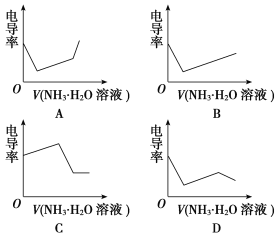
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茫茫黑夜中,航标灯为航海员指明了方向航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中
①铝合金是阳极②铝合金是负极③海水是电解液④铝合金电极发生还原反应
A. ②④ B. ②③ C. ①② D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构的下列说法中正确的是( )
A. 碘升华时破坏了共价键
B. 含极性键的共价化合物一定是电解质
C. 氯化钠固体中的离子键在溶于水时被破坏
D. HF的分子间作用力大于HCl,故HF比HCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 第3周期所含元素中钠的第一电离能最小
B. 铝的第一电离能比镁的第一电离能大
C. 在所有的元素中,F的第一电离能最大
D. 钾的第一电离能比镁的第一电离能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见有机物的转化关系,下列说法正确的是( )
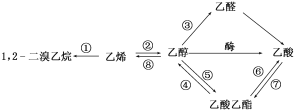
A.反应①是加成反应,反应⑧是消去反应,其他所标明的反应都是取代反应
B.上述物质中能与NaOH溶液反应的只有乙酸
C.1,2二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种
D.等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
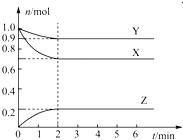
(1)该反应的化学方程式为________________________;
(2)反应开始至2min,用气体Z表示的反应速率为_____________;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的__________倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__________反应(填“放热”或“吸热”).
(4)若上述反应在2min后的t1~t6内反应速率与反应时间图象如下,
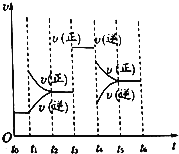
在每一时刻均改变一个影响反应速率的因素,则①t1、t3、t4时刻体系中分别改变的是什么条件?
t1:______________,t3:_______________,t4:_____________.
②下列各时间段时,Z的体积分数最高的是___________
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com