
【题目】已知室温时,0.1mol/L的一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.溶液的PH=4
B.升高温度,溶液PH增大
C.此酸的电离平衡常数为1×10-7
D.由HA电离的c(H+)约为水电离出来的c(H+)的106倍
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是
2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是

A. 若温度升高,混合气体的颜色变深
B. 在该温度下反应2NO2(g)![]() N2O4(g)的平衡常K为25/9
N2O4(g)的平衡常K为25/9
C. 反应达平衡后,将反应容器的容积减少一半,平衡向正反应方向移动
D. 反应达平衡后,向此容器中通入NO2气体,则c(NO2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B. 25℃时,等体积等物质的量浓度的硝酸与氨水混合后,溶液pH=7
C. 25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D. 25℃时,pH=2的酸HA溶液与pH=12的玻BOH溶液等体积混合后,所得溶液呈酸性,证明HA为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )
A. N2、H2完全转化为NH3 B. N2、H2、NH3在容器中共存
C. 反应已达到化学平衡状态 D. N2、H2、NH3的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,描述正确的是( )

A. 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B. 反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C. 反应的化学方程式为:X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. 反应进行到10 s后,该反应停止进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成是目前普遍使用的人工固氮方法。
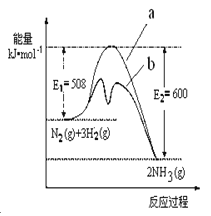
(1) 根据图提供的信息,写出该反应的热化学方程 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
(2) 在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是 ( )
A.在含有大量Al3+的无色溶液中:Cu2+、Na+、Cl-、SO42-
B.在含有大量H+ 的 溶液中:Na+、K+、CO32-、NO3-
C.在强酸的溶液中:NH4+、Na+、SO42-、Cl-
D.在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、N、O、Na、S、Cl都是中学化学中的常见元素,根据题意回答与这些元素有关的问题:
(1)画出Na原子结构示意图_______,Na2O2可用作供氧剂,其电子式为_______。
(2)Cl2是一种大气污染物,装有液氯的钢瓶上应贴的标签是_______(填编号)。

氯气泄漏可用NaHSO3溶液来处理,写出相关的离子反应方程式_____________。
(3)25C时,利用pH试纸测得0.1mol/L氨水的pH约为11,则可以估算出氨水的电离常数约为_____;向10mL此溶液中通入少量氨气,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
(4)有两种化合物同时含有上述六元素中的四种元素。将这两种化合物的溶液混合后,恰好完全反应,生成物之一M仍含有这四种元素,该反应的离子方程式为______________。若M溶液的pH =5,则由水电离出的c(H+)=_______mol/L,该溶液离子浓度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氯化铜溶液与锌粒反应:Cu2++Zn=Zn2++Cu
B.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com