
分析 (1)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(2)氢氟酸能够与玻璃中的二氧化硅反应生成四氟化硅和水;
(3)向氯化铝中滴加氢氧化钠,开始氢氧化钠较少,反应产生氢氧化铝,此后过量的氢氧化钠将氢氧化铝溶解,生成偏铝酸钠和水.
解答 解:(1)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,离子方程式为:Al2O3+20H-+3H2O=2[Al(OH)]-,
故答案为:Al2O3+20H-+3H2O=2[Al(OH)]-;
(2)氢氟酸与二氧化硅反应的化学方程式为:SiO2+4HF═SiF4↑+2H2O,所以用氢氟酸能够雕刻玻璃,故答案为:SiO2+4HF═SiF4↑+2H2O;
(3)向氯化铝中滴加氢氧化钠,开始氢氧化钠较少,反应产生氢氧化铝,Al3++3OH-=Al(OH)3↓,过量的氢氧化钠将氢氧化铝溶解,生成偏铝酸钠和水:Al(OH)3+OH-=[Al(OH)4]-,故答案为:Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=[Al(OH)4]-.
点评 本题考查了离子方程式、化学方程式的书写方法和注意问题,难溶物、弱电解质、物质性质的分析判断是解题关键.题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙烯 | B. | 甲醛和葡萄糖 | C. | 乙烯和乙酸乙酯 | D. | 丙烷和乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
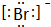 .
.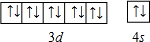 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
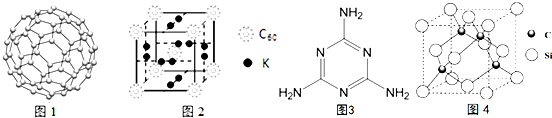 σ
σ查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com