
下列有关金属铁的腐蚀与防护,说法正确的是
A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.铁与电源正极连接可实现电化学保护
D.将钢管与铜管一起堆放时可保护钢管少受腐蚀
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:实验题
(本题共12分)
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:填空题
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
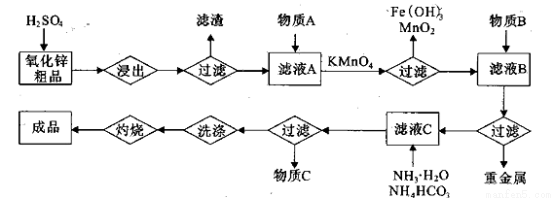
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、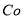 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
A.NH3.H2O B.Na2CO3 C. H2SO4 D.ZnO
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表:

该温度下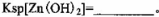 。
。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中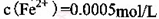 ,则处理1
,则处理1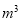 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、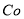 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是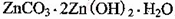 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
关于图中各装置的叙述不正确的是
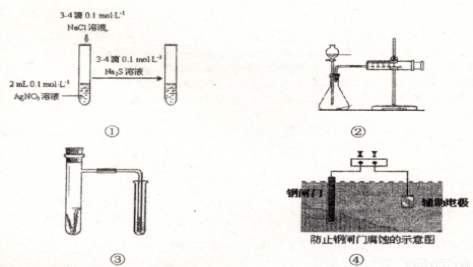
A. 装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B. 装置②能测量锌与硫酸的反应速率
C. 装置③能验证铁的吸氧腐蚀
D. 装置④的X电极是负极,则能验证外接电源的阴极保护法
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
利用下图装置可以模拟铁的电化学防护。下列说法不正确的是
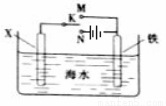
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B. 若X为锌棒,开关K置于M处,铁极发生氧化反应
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D. 若X为碳棒,开关K置于N处,X极发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2014秋季江西省赣州市十二县高一上学期期中联考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42—+Ba2++2OH-=BaSO4↓+2H2O
C.氧化铜与稀硫酸反应:2H++O2-=H2O
D.碳酸氢钠溶液中加入盐酸:CO32—+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:填空题
(7分)某氯化钠样品中混有碘化钠。为获得纯净的氯化钠固体,设计了如下图所示的实验流程:
【查阅资料】氯的单质可以置换出碘化物中的碘。
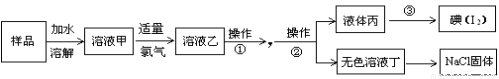
阅读上述实验流程,完成下列填空:
(1)写出溶液甲与氯水发生反应的离子方程式 。
(2)从“无色溶液丁”中获取氯化钠固体必要的实验操作是:___________(填序号)。
A.蒸馏 B.蒸发结晶 C.冷却结晶
(3)操作①的名称 ;所需要的主要试剂是 。
(4)操作②的名称 ;从液体丙获得碘的方法是 。
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江苏省高二(文)上学期期中化学试卷(解析版) 题型:实验题
(10分)某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。请你参与并完成对有关问题的解答。
【资料获悉】
1、“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。
2、Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl= NaCl+H2O +CO2↑
【实验设计】
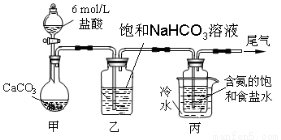
【实验探究】
(1)装置乙的作用是 。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。
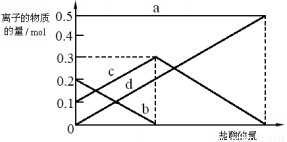
则曲线c对应的溶液中的离子是 (填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 。
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com