
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。![]() 与
与![]() 在水体和大气中的部分转化如下图所示。
在水体和大气中的部分转化如下图所示。

(1)碘在元素周期表的位置:______________________,其中一种人工放射性核素131I常用于甲亢的治疗,该核素含有的中子数为___________。
(2)结合元素周期律分析Cl-、I-的还原性强弱:同主族元素的原子,从上到下,____________。
(3)水体中的I-的非酸性条件下不易被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的
的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的![]() 氧化的原因是_____________________。
氧化的原因是_____________________。
(4)大气中的部分碘源于![]() 对海水中I-的氧化,有资料显示:水体中若含有
对海水中I-的氧化,有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
已知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂 组成 | 反应前溶液 的 | 反应后溶液 的 |
转化率 |
的生成量 |
A |
|
|
| 约 | —— |
B |
|
|
| —— | 少量 |
C |
|
|
| 约 | 大量 |
① a=__________。
② 用离子方程式解释A中pH增大的原因_______________________________________。
③ 写出B中产生![]() 的离子方程式_________________________________________。
的离子方程式_________________________________________。
④ C中实验进行20s后,发现溶液中![]() 浓度开始下降。导致下降的直接原因有_______。
浓度开始下降。导致下降的直接原因有_______。
A ![]() 减小 B
减小 B ![]() 减小 C
减小 C ![]() 不断生成
不断生成
【答案】第5周期第VIIA族 78 原子半径逐渐增大,得电子能力逐渐减弱,非金属性Cl>I,单质氧化性Cl2>I2,因此离子的还原性Cl-<I- 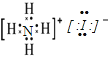 NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2
NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2![]() 2I2+4OH-正向移动 3
2I2+4OH-正向移动 3![]() 10-2 H2O+2I-+O3
10-2 H2O+2I-+O3![]() I2+2OH-+O2 2Fe2++O3+5H2O=2Fe(OH)3+4H++O2 B
I2+2OH-+O2 2Fe2++O3+5H2O=2Fe(OH)3+4H++O2 B
【解析】
(1)碘是53号元素;中子数=质量数-质子数;
(2)同主族元素的原子,从上到下,原子半径逐渐增大,得电子能力逐渐减弱;
(3)碘化铵为离子化合物,含有NH4+和I-;NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2![]() 2I2+4OH-正向移动;
2I2+4OH-正向移动;
(4)①根据对照试验,控制变量来分析解答;
② A中发生的反应为H2O+2I-+O3![]() I2+2OH-+O2,生成了OH-,溶液的碱性增强,pH增大;
I2+2OH-+O2,生成了OH-,溶液的碱性增强,pH增大;
③B中反应后生成了Fe(OH)3,溶液的pH减小,说明有H+生成,根据电子守恒和电荷守恒写出离子方程式;
④根据浓度对平衡移动的影响分析解答。
(1)碘是53号元素,碘原子核外有5个电子层,最外层电子数为7,所以碘在元素周期表中位于:第5周期第VIIA族;131I中的质量数为131,质子数为53,则中子数=质量数-质子数=131-53=78。
故答案为:第5周期第VIIA族;78;
(2)同主族元素的原子,从上到下,原子半径逐渐增大,得电子能力逐渐减弱,非金属性Cl>I,单质氧化性Cl2>I2,因此离子的还原性Cl-<I-。
故答案为:原子半径逐渐增大,的电子能力逐渐减弱,非金属性Cl>I,单质氧化性Cl2>I2,因此离子的还原性Cl-<I-;
(3)碘化铵为离子化合物,含有NH4+和I-,故电子式为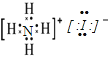 ;
;
NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2![]() 2I2+4OH-正向移动,所以其水溶液易被空气中的O2氧化。
2I2+4OH-正向移动,所以其水溶液易被空气中的O2氧化。
故答案为:NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2![]() 2I2+4OH-正向移动;
2I2+4OH-正向移动;
(4)①该实验为探究水体中若含有![]() ,会对O3氧化I-产生促进作用,应在其它条件相同的条件下实验,对比A、B、C3组实验,若要使Cl-浓度相同,则a的值为3
,会对O3氧化I-产生促进作用,应在其它条件相同的条件下实验,对比A、B、C3组实验,若要使Cl-浓度相同,则a的值为3![]() 10-2。
10-2。
故答案为:3![]() 10-2;
10-2;
② A中发生的反应为H2O+2I-![]() I2+2OH-+O2,生成了OH-,溶液的碱性增强,pH增大。
I2+2OH-+O2,生成了OH-,溶液的碱性增强,pH增大。
故答案为:H2O+2I-+O3![]() I2+2OH-+O2;
I2+2OH-+O2;
③B中反应后生成了Fe(OH)3,溶液的pH减小,说明有H+生成,根据电子守恒和电荷守恒写出离子方程式为:2Fe2++O3+5H2O=2Fe(OH)3+4H++O2。
故答案为:2Fe2++O3+5H2O=2Fe(OH)3+4H++O2;
④对比表格中第A、C组实验前后pH可得,A组pH增大,c(H+)减小,C组pH减小,c(H+)增大,C中实验进行20s后,发现溶液中![]() 浓度开始下降,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,故A项不选;
浓度开始下降,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,故A项不选;
若c(I-)减小,导致I2(aq)+I-(aq)![]() I3-(aq)的平衡左移,所以I3-浓度下降,所以c(I-)减小是导致I3-浓度下降的直接原因,故选B项;
I3-(aq)的平衡左移,所以I3-浓度下降,所以c(I-)减小是导致I3-浓度下降的直接原因,故选B项;
若I2(g)不断生成,导致I2(aq)![]() I2(g)的溶解平衡右移,使溶液中c(I2)减小,导致 I2(aq)+I-(aq)
I2(g)的溶解平衡右移,使溶液中c(I2)减小,导致 I2(aq)+I-(aq)![]() I3-(aq)的平衡左移,则I3-浓度下降,但不是导致I3-浓度下降的直接原因,故不选C项。
I3-(aq)的平衡左移,则I3-浓度下降,但不是导致I3-浓度下降的直接原因,故不选C项。
故选B。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】将1 mol X、3 mol Y充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g) +3Y(g) ![]() 2Z(g);ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
2Z(g);ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
A.升高温度,X的体积分数减小
B.缩小体积,Y的物质的量浓度不变
C.保持容器体积不变,充入1mol的稀有气体He,Z的浓度不变
D.保持容器体积不变,充入2mol的Z(g),X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列
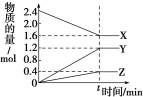
表述中正确的是
A.反应的化学方程式为2X = 3Y + Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。下列有关这套装置的说法中错误的是

A.甲池中的电极反应式为![]()
B.电解质溶液再生池内发生的只是物理变化,循环物质E为水
C.乙池中Cu电极电势比甲池中Cu电极电势低
D.若阴离子交换膜处迁移的![]() 的物质的量为1mol,两电极的质量差为64g
的物质的量为1mol,两电极的质量差为64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A. 11.2gB. 5.6gC. 2.8gD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)NOx和SO2在空气中存在下列平衡:2NO(g)+O2(g)![]() 2NO2(g)△H=-113.0kJmol-1,2SO2(g)+O2(g)
2NO2(g)△H=-113.0kJmol-1,2SO2(g)+O2(g)![]() 2SO3(g)△H=-296.6kJmol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
2SO3(g)△H=-296.6kJmol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为______________________________。
②随温度降低,该反应化学平衡常数变化趋势是______(填“增大”或“减小”或“不变”)。
(2)提高2SO2+O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在10L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是______(填字母)。
a.温度和容器体积不变,充入1.0molHe
b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,改用高效催化剂
d.在其他条件不变时,减少容器的体积
e.在其他条件不变时,升高体系温度
(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图

①电解饱和食盐水的化学方程式是__________________________;
②若用NaOH溶液吸收含二氧化硫的废气,当二者恰好完全反应生成NaHSO3时,溶液的PH<7,则该溶液中各离子浓度由大到小的顺序为_________________________;
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1.4gC2H4、C3H6 的混合气体中,所含碳原子总数为 0. lNA
B. 1.0 mol CH4 与 Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0NA
C. 标准状况下,22. 4LC2H6 中所含极性共价键的数目为 7NA
D. 50mL l2mol·L 的浓盐酸与足量 MnO2 反应,转移电子总数为 0. 3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是________________________________________________________________________。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:_____________________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(4)实验室溶解该熔融物,最好选用下列试剂中的____(填字母),理由是__________。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2是一种重要的光催化剂。以钛酸酯Ti(OR)4为原料制备纳米TiO2的步骤如下:
①组装装置如下图所示,保持温度约为65℃,先将30mL钛酸四丁酯[Ti(OC4H9)4]加入盛有无水乙醇的三颈烧瓶,再加入3mL乙酰丙酮,充分搅拌;
②将含水20%的乙醇溶液缓慢滴入三颈烧瓶中,得到二氧化钛溶胶;
③将二氧化钛溶胶干燥得到二氧化钛凝胶,灼烧凝胶得到纳米TiO2。
已知,钛酸四丁酯能溶于除酮类物质以外的大部分有机溶剂,遇水剧烈水解;Ti(OH)4不稳定,易脱水生成TiO2,回答下列问题:
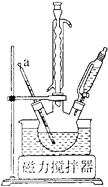
(1)仪器a的名称是_______,冷凝管的作用是________。
(2)加入的乙酰丙酮可以减慢水解反应的速率,其原理可能是________(填标号)。
a.增加反应的焓变 b.增大反应的活化能
c.减小反应的焓变 d.降低反应的活化能
制备过程中,减慢水解反应速率的措施还有________。
(3)步骤②中制备二氧化钛溶胶的化学方程式为________。下图所示实验装置中,可用于灼烧二氧化钛凝胶的是________(填标号)。
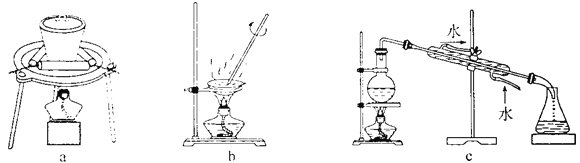
(4)测定样品中TiO2纯度的方法是:精确称取0.2000 g样品放入锥形瓶中,加入硫酸和硫酸铵的混合溶液,加强热使其溶解。冷却后,加入一定量稀盐酸得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+。待过量的金属铝完全溶解并冷却后,加入指示剂,用0.1000 mol·L-lNH4Fe(SO4)2溶液滴定至终点。重复操作2次,消耗0.1000 mol·L-1 NH4Fe(SO4)2溶液的平均值为20.00 mL(已知:Ti3+ +Fe3++H2O=TiO2+ +Fe2+ +2H+)。
①加入金属铝的作用除了还原TiO2+外,另一个作用是________________。
②滴定时所用的指示剂为____________(填标号)
a.酚酞溶液 b. KSCN溶液 c. KMnO4溶液 d.淀粉溶液
③样品中TiO2的质量分数为________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com