
| A. | 分液时,水溶液一定从下口放出 | |
| B. | 蒸馏时,如果温度计水银球下端高于蒸馏烧瓶支管口上沿,收集到的馏分沸点偏高 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 量取20.0mL浓硫酸时,俯视读数,所取液体体积偏大 |
分析 A.分液时,上层液体从上口倒出,下层液体从下端流出;
B.蒸馏时,温度计用于测量馏分的温度;
C.滴定时,眼睛应注意观察溶液颜色变化;
D.根据量筒的刻度从下到上增大的特点判断.
解答 解:A.分液时,上层液体从上口倒出,下层液体从下端流出,但水的密度与有机层的密度大小不确定,如水在上层,则应从上口倒出,故A错误;
B.蒸馏时,温度计用于测量馏分的温度,蒸馏烧瓶中,从下到上温度逐渐降低,则如果温度计水银球下端高于蒸馏烧瓶支管口上沿,收集到的馏分沸点偏高,故B正确;
C.滴定时,眼睛应注意观察溶液颜色变化,以及时判断滴定终点,故C错误;
D.量取20.0mL浓硫酸时,俯视读数,则读数偏大,所取液体体积偏小,故D错误.
故选B.
点评 本题综合考查物质的分离以及量筒的使用,为高频考点,侧重于学生的实验基本操作的考查,注意把握分离方法以及仪器的使用,难度不大.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
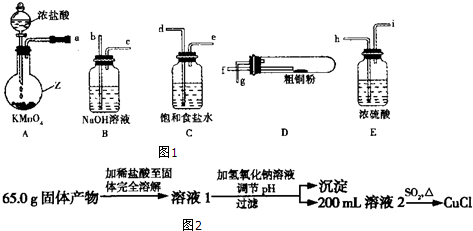
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气跟烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| B. | 漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 将氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | pH=0的透明溶液中,Na+、Fe3+、MnO4-、NO3- | |
| C. | 稀溴水中:H+、Na+、SO42-、葡萄糖分子 | |
| D. | 0.1mol•L-1的NH4HCO3溶液中:Ca2+、K+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ | |
| B. | 四种铈的核素${\;}_{58}^{136}$Ce、${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce,它们互为同位素 | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ | |
| D. | 金属铈应储存于阴凉、通风的地方,包装要密封,不可与空气接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率增大,逆反应速率减小 | |
| B. | 逆反应速率增大,正反应速率减小 | |
| C. | 正、逆反应速率均增大,但是逆反应速率增大的程度大于正反应速率增大的程度 | |
| D. | 正、逆反应速率均增大,而且增大的程度一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
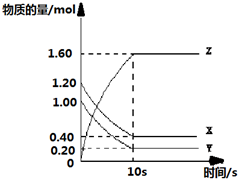
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com