


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 b.
b.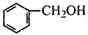 c.
c.
 b.
b. c.
c.
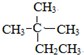 的名称为
的名称为 核磁共振氢谱有
核磁共振氢谱有 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ.则理论上1mol N2生成NH3
(1)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ.则理论上1mol N2生成NH3查看答案和解析>>
科目:高中化学 来源: 题型:
 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.
一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯碱、烧碱均属于碱类 |
| B、CO2、SiO2、SO2均属于酸性氧化物 |
| C、醋酸、硫酸、硝酸均属于酸类 |
| D、Na2CO3、Na2SO3、NaCl均属于钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgI和干冰都可用于人工降雨 |
| B、凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C、乙醇可以被氧化为乙酸,乙醇和乙酸都是常用调味品的主要成分 |
| D、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com