
| A、向足量的NaHS 溶液中通入少量氯气:HS-+Cl2=S↓+H++2Cl- |
| B、碳酸钡溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ |
| C、饱和的Na2CO3溶液中通CO2气体:2Na++CO32-+H2O+CO2=2NaHCO3↓ |
D、把水杨酸(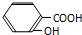 )加到足量的Na2C03溶液中: )加到足量的Na2C03溶液中: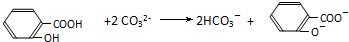 |
 )加到足量的Na2C03溶液中的离子反应为
)加到足量的Na2C03溶液中的离子反应为 ,故D正确;
,故D正确;

科目:高中化学 来源: 题型:
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L液态水分解成2L氢气与1L氧气吸收571.6 kJ热量 |
| B、2 mol氢气与1mol氧气反应生成2mol气态水放出热量大于571.6 kJ |
| C、在相同条件下,2 mol氢气与1mol氧气的能量总和大于2mol液态水的能量 |
| D、使用催化剂能降低该反应的活化能使反应放出得热量小于571.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、做中和热测定实验时,若没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替 |
| B、中和滴定实验中,左手调控滴定管的活塞,右手持锥形瓶,眼睛注视滴定管中液面的变化 |
| C、溴蒸汽和二氧化氮两种红棕色气体可用淀粉碘化钾溶液来鉴别 |
| D、除去蛋白质溶液中少量的NaCl,可将装有混合液的半透膜袋浸入流动的蒸馏水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠溶于水:Na+2H2O═Na++2OH-+H2↑ |
| B、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
| C、碳酸钙与盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、硫酸铝溶液与氨水的反应:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2(SO2):通入盛有品红溶液的冼气瓶后收集 |
| B、Fe2+(Fe3+):加KSCN溶液后过滤 |
| C、Cl2(HCl):通过盛有饱和氯化钠水溶液的洗气瓶后收集 |
| D、氯化铵溶液(FeCl3):加足量NaOH溶液后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
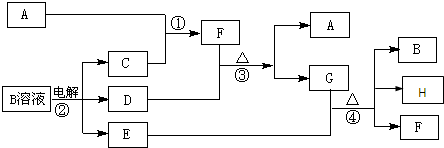
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的硫酸溶液时,应将量取好的浓硫酸先放入烧杯中,然后加水稀释 |
| B、中和滴定实验前,所使用的滴定管和锥形瓶必须洗净,并用待测液润洗 |
| C、测定Na2CO3、Na2SO4两溶液的pH,比较碳、硫的非金属性强弱 |
| D、硫酸铜晶体结晶水含量的测定实验中,盛晶体的坩埚灼烧后,需放在石棉网上冷却后称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 )是味精的主要成分.当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.
)是味精的主要成分.当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com