
分析 (1)在水溶液中能完全电离的化合物为强电解质,包括强酸、强碱和绝多数的盐;在水溶液中不能完全电离的化合物为弱电解质,包括弱酸、弱碱、少部分盐和水,据此分析;
(2)根据抗酸药物有效成分能中和胃里过多的盐酸分析;
(3)根据得失电子数守恒来分析计算;
(4)在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,KMnO4为氧化剂,HCl为还原剂,据此分析.
解答 解:(1)在水溶液中能完全电离的化合物为强电解质,包括强酸、强碱和绝多数的盐,故①硫酸 ④硫酸钡 ⑧氯化氢⑫NaHCO3属于强电解质;在水溶液中不能完全电离的化合物为弱电解质,包括弱酸、弱碱、少部分盐和水,故 ⑦醋酸 为弱电解质,故答案为:①④⑧⑫;⑦;
(2)碳酸氢钠和氢氧化铝都能中和胃里过多的盐酸.碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,反应的离子方程式为:HCO3-+H+=CO2↑+H2O;氢氧化铝和盐酸反应生成氯化铝和水,反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:HCO3-+H+=CO2↑+H2O;Al(OH)3+3H+═Al3++3H2O;
(3)1mol二氧化锰得2mol电子,而当生成1mol氯气时失去2mol电子,故根据得失电子数守恒可知,二氧化锰的计量数为1,氯气的计量数也为1,根据质量守恒可知,氯化锰的计量数也为1,则HCl的计量数为4,故水的计量数为2,此反应转移2mol电子,故电子转移情况为 ,故答案为:
,故答案为: ;
;
(4)在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,KMnO4为氧化剂,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,当有2molKMnO4参加反应时,有10molHCl被氧化,则氧化剂与还原剂的物质的量之比为1:5,故答案为:1:5.
点评 本题考查了得失电子数的分析和用双线桥标示电子的得失,并考查了强弱电解质的区别,应注意的是强弱电解质的本质区别是能否完全电离.


科目:高中化学 来源: 题型:选择题
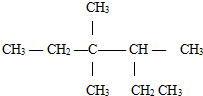
| A. | 3,3-二甲基-2-乙基戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 3,3,4-三甲基己烷 | D. | 3,4,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的质量仍然相等 | B. | 溶质的质量仍然相等 | ||
| C. | 溶剂的质量仍然相等 | D. | 溶液的密度仍然相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
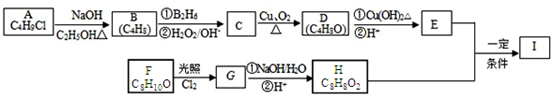

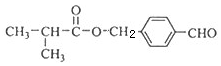 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于溶液 | B. | 能产生丁达尔效应 | ||
| C. | 分散质粒子能透过滤纸 | D. | 纳米碳粒子能够发生布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的正极和电解池的阳极都是发生氧化反应 | |
| B. | 用铂做电极电解NaOH溶液时,溶质的质量不变,但浓度却随着电解的进行而增大 | |
| C. | 电解食盐水时,由于OH-离子向阳极移动,所以加酚酞时阳极附近可变红色 | |
| D. | 电解食盐水时,阴极区溶液里H+离子的浓度相对增大,使酚酞试液不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ③④⑤⑥ | C. | ②④⑤⑥ | D. | ①③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com