
海洋中资源丰富,以海水为原料可制得一系列产品,如下图所示:

下列有关说法正确的是
A.第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.将第②步结晶出的MgCl2 6H2O在空气中加热分解制备无水MgCl2
6H2O在空气中加热分解制备无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.电解饱和食盐水时,在阴极区生成NaOH
【知识点】海水资源及其综合利用 D2
【答案解析】D 解析: A、除去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;
加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;故A错误; B、结晶出的MgCl•6H2O在空气中加热分解得到氯化镁和水,氯化镁水解得不到无水MgCl2,应在氯化氢气流中脱水,防止镁离子水解,故B错误; C、③是溴元素被氧化为溴单质,④是溴单质被还原为溴离子,⑤是溴元素被氧化为溴单质;此过程是富集溴的操作,故C错误; D、电解饱和食盐水溶液中阴离子Cl-移向阳极,阳离子H+移向阴极得到电子发生还原反应生成氢气,电极附近氢氧根离子浓度增大,形成氢氧化钠,故D正确。
【思路点拨】本题考查了海水提取溴的工艺流程,氯碱工业的反应原理,掌握基础是解题关键,题目较简单。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)写出一种工业制备单质F的化学方程式:____________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为___________, 请用离子方程式解释该溶液呈碱性的原因____________________________________________;
(3)实验室用F从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
|
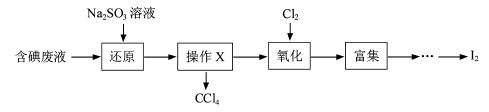
①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________ ;
②操作X的名称为___________________。
③已知:5SO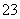 +2IO
+2IO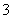 +2H+===I2+5SO
+2H+===I2+5SO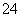 +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO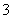 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO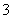 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO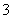 ;若溶液不变蓝,说明废水中不含有IO
;若溶液不变蓝,说明废水中不含有IO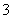 。
。
(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化溴(BrCl)化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,跟水反应的化学方程式为BrCl+ H2O = HCl+ HBrO,关于BrCl叙述错误的是:( )
A. 固态溴化碘是由极性键构成的分子晶体 B. 和NaOH溶液反应生成NaCl和NaBrO
C. 能使湿润的淀粉碘化钾试纸变蓝 D. 与水反应时BrCl既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
、在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象
和结论一定正确的是 ( )
A.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
B.加入有色布条,一会儿有色布条褪色。说明溶液中有Cl2分子存在
C.加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)  CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”)
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
E.容器中气体密度不变 F.1mol H—H键断裂的同时断裂2 mol H-O键
(4) 在850℃时,可逆反应:CO2(g) + H2(g)  CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
3min—4min达到平衡时CO的平衡浓度c3= (c3精确到小数点后面三位数),CO2 (g)的转化率= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
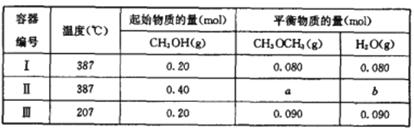
(1) 该反应的化学平衡常数表达式为K=__________.
(2) 该反应的正反应为___________(填“放热”或“吸热”)反应。
(3) 容器I中的反应达到平衡时所需的时间____________(填“大于”“小于”或等于)容器II中的。
(4)a= b=
(5)已知下面两个反应(m、n.均大于0):
反应①:CO(g)+2H2(g) ⇌ CH3OH(g) ΔH=-m kJ·mol-1
反应②2 CO(g)+4 H2(g) ⇌ CH3OCH3(g)+H2O(g) ΔH=-n kJ·mol-1
则下列m与n的关系中,正确的是 (填字母)。
A. n﹥2m B. m ﹥2 n C. n﹥m D. m﹥3n
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com