
| A、酸性KMnO4溶液 |
| B、溴水 |
| C、碘水 |
| D、硝酸银溶液 |


科目:高中化学 来源: 题型:

| A、①表示随温度升高,平衡常数的变化 |
| B、②表示t1时刻加入催化剂,反应速率随时间的变化 |
| C、③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 |
| D、④表示CO的体积分数随充入Cl2量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G | I | J | ||
| 4 | K |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3A(g)+B(g) |
| xC(g)+2D(g) |
| 5 |
| 6 |
| A、0.25mol/L/s |
| B、0.1 |
| C、0.05mol/(L?s) |
| D、条件不足,无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、140mL | B、120mL |
| C、100mL | D、80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
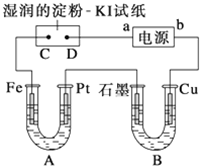 电解装置如图所示.图中B装置盛1L2mol?L-1的Na2SO4溶液,A装置中盛1L2mol?L-1 AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:
电解装置如图所示.图中B装置盛1L2mol?L-1的Na2SO4溶液,A装置中盛1L2mol?L-1 AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17.6g | B、22.4g |
| C、2.4g | D、4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com