
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | ||
| S | 112.8 | 444.6 | 略 | ||
| S2Cl2 | -77 | 137 |
|

(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗)在G和H之间增加干燥装置
(2)MnO2+4H++2Cl— Mn2++Cl2↑+2H2O 2S+Cl2
Mn2++Cl2↑+2H2O 2S+Cl2 S2Cl2
S2Cl2
(3)饱和食盐水(或水)
(4)蒸馏烧瓶 导气、冷凝
(5)产率降低
(6)SCl2、Cl2、S(任写其中两种即可) 控制浓盐酸的滴速不要过快
解析试题分析:(1)①G收集产品,H中氢氧化钠溶液中水蒸气易挥发,进入G中,易使S2Cl2水解.在G和H之间增加干燥装置.
②若B中气压过大,A中浓盐酸不容易滴下,A与B之间应接一根导管,使A与B内气压相平衡,浓盐酸在重力作用下顺利滴入烧瓶.故答案为:在G和H之间增加干燥装置.
(2)用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取,反应离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O. 2S+Cl2 S2Cl2
S2Cl2
(3)氯气中氯化氢用饱和食盐水吸收,用浓硫酸干燥,先除氯化氢,后干燥.故C中试剂饱和食盐水(或水).
(4)仪器B为蒸馏烧瓶,F导管较长有两个作用:导出产品和冷凝产品.导气、冷凝.
(5)产品热稳定性差,温度过高,产品部分生成了二氯化硫,产率偏低.故答案为:产率降低(或S2Cl2分解)。
(6)由信息可知,可能因温度、水蒸气因素引入HCl,S,SO2,SCl2杂质.若滴加盐酸过快,部分水蒸气没有被硫酸吸收,导入E管中.故应控制浓盐酸的滴速不要过快.
考点:考查实验原理、及学生对装置的理解、评价等相关知识。


科目:高中化学 来源: 题型:实验题
(共15分) 某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下: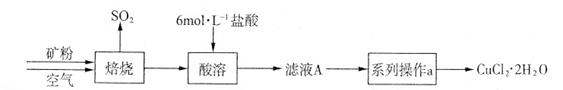
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有_______________ 、 _______________ 。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是_______ (填下列各项中序号)。
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl-  CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是____ (填下列各项中序号)。 a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为下列四阶段:
第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 _______________ 。
②300~400oC范围内,固体质量明显增加的原因是_______________,上图所示过程中,CuSO4固体能稳定存在的阶段是__________(填下列各项中序号)。
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
a.装置组装完成后,应立即进行气密性检查,请写出检查A-D装置气密性的操作 __________ 。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为_______________ 溶液。
c.若原CuS矿样的质量为l0.0 g(含加热不反应的杂质),在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.4 g,则原矿样中CuS的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是: ;
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
若有6 mol的HCl参加反应,则转移的电子总数为 ;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B: ,D: 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B: ,D: 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题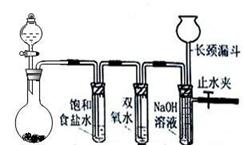
A B C D
(1)试管B中饱和食盐水的作用 ;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是 ;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为 ,试管D中的气体检验方法为__________________;
(5)有的同学对上述实验中试管D中气体来源产生质疑,你认为可能的来源有 (用化学方程式表示),对于质疑可以采用对比实验来解决。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组在实验室中用铜粉(含铁粉5%以上)制取胆矾(CuSO4·5H2O)并检验其纯度,限选试剂:3 mol·L-1H2SO4溶液、浓硝酸、3%H2O2溶液、0.2 mol·L-1NaOH溶液、20% KSCN溶液、BaCl2溶液。有关物质溶解度如下表(单位g/100 g H2O):
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4 | 14.3 | 20.7 | 28.5 | 40.0 | 55.0 | 75.4 |
| Cu(NO3)2 | 81.8 | 124.8 | 163.1 | 181.8 | 207.8 | 247.3 |
| 实验步骤 | 预期现象 |
| 步骤1:除铁。将铜粉置于烧杯中,__________________ | _______________________ |
| 步骤2:溶解。将步骤1得到的铜粉置于烧杯中, __________________________ | _______________________ |
| 步骤3:结晶。将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是 。
(2)实验室常用如下图所示装置制取并收集氨气。
①实验室制取氨气反应的化学方程式是 。
②图中方框内收集氨气的装置可选用 (填字母序号)。
③尾气处理装置中使用倒扣漏斗的作用是 。
(3)工业上用NH3制取NO反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。
(1)该过程中能循环利用的物质为 。
(2)在该过程中,使用膜反应器及时分离出HI分解产生的H2,目的是 (用平衡移动的原理解释)。
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。已知浓硫酸的沸点为338℃,加热时酒灯火焰的温度为400℃~500℃。
①甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,请解释生成该白色沉淀的可能原因 (用离子方程式表示)。
②乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检查)。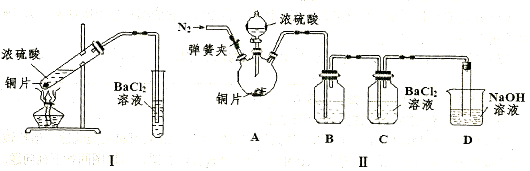
a.打开弹簧夹通入N2,一段时间后关闭弹簧夹;b.滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。操作a的目的是 ,装置B中的剂是 。
③丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,产生不溶于盐酸的白色沉淀,丙同学滴加的试剂可能是 (填字母编号)。
a.NaOH溶液 b.H2O2溶液 c.新制氯水 d.酸性KmnO4溶液
④装置D中与导管连接的是硬质玻璃管,则装置D的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列根据实验操作和现象得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐溶液滴入AgNO3溶液 | 有白色沉淀 | 该钠盐不一定是NaCl |
| B | 浓硫酸与NaCl固体混合加热 | 有气体产生 | 硫酸的酸性比HCl强 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液 | 出现黄色沉淀 (PbI2) | KSP(PbI2)<KSP(PbCl2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com