
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS),共同生产MnO2和Zn(干电池原料)。
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。

(1)A中属于还原产物的是 。
(2)MnCO3、Zn2(OH)2CO3的作用是 ;Ⅱ需要加热的原因是 ;C的化学式是 。
(3)Ⅲ中发生的离子方程式为 , ;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是 。
(1)MnSO4
(2)增大溶液的pH,使Fe3+和Al3+均生成沉淀;促进Fe3+、Al3+的水解;H2SO4
(3)Mn2++CO32-=MnCO3 2Zn2++2CO32-+H2O=Zn2(OH)2CO3↓+CO2↑
(4)纯碱和硫酸
【解析】(1)由已知信息条件知,Mn元素化合价由+4价降低为+2价,民以A中还原产物为MnSO4;
(2)由工艺流程图知,MnCO3、Zn(OH)2CO3的作用就是调节pH,使Fe3+和Al3+均生成沉淀。Fe3+、Al3+沉淀容易形成胶体,不利于氢氧化铝、氢氧化铁沉淀,所以Ⅱ加热的目的是加速沉淀生成,防止胶体出现,并使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用。
(4)溶液B中含有Mn2+、Zn2+,根据流程图,加入Na2CO3后,生成MnCO3和Zn2(OH)2CO3,离子方程式是,Mn2++CO32-=MnCO3,2Zn2++2CO32-+H2O=Zn2(OH)2CO3↓+CO2↑。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(非金属)(解析版) 题型:选择题
如A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产下图所示,物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。下列说法中不正确的是:
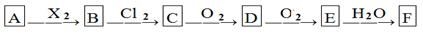
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学弱电解电离(解析版) 题型:选择题
常温下,pH=12的氢氧化钠溶液pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合前的醋酸约1%发生电离
B.混合后的溶液中c(Na+)<c(CH3COO-)
C.氢氧化钠和醋酸和浓度不相等
D.混合后的溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学常见仪器的使用(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是 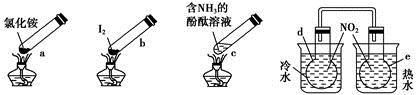
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.e内气体颜色变浅,d内气体颜色加深
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
垃圾焚烧发电产生的烟气中含烟尘、二氧化硫、氮氧化物、氯化氢等有害物质,处理流程如下:
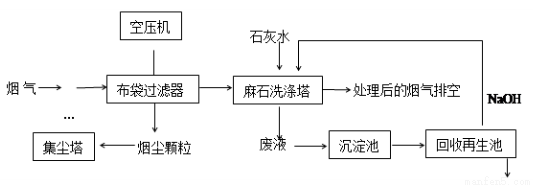
(1)麻石洗涤塔中设置多层格栅,上面放置大量耐酸碱塑料小球,塔内设置多层上喷下淋水嘴,“烟气”从塔底进入,目的是 。
(2)若NO2和NO气体以物质的量之比1:1混合通入石灰水中,发生氧化还原反应生成一种正盐和水,请写出反应的化学方程式 ;已知此正盐的水溶液呈碱性,用离子方程式表示 。
(3)废液在沉淀池中慢慢沉降,沉淀主要含 ;在回收再生池中加入NaOH固体的作用是 。
(4)环境检测部门测量处理前后烟气中烟尘的含量见下表:
项目 | 监测结果 | 国标号 | |
处理前 | 处理后 | GWKB3—2000 | |
烟尘(mg/m3) | 13929.0 | 61.0 | 80 |
其获得监测结果中的数据使用的测定方法为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
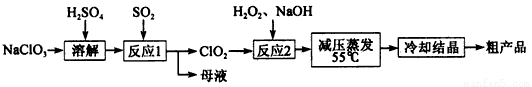
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
下列实验中,所采取的分离方法与对应原理都正确的是
选项 | 目的 | 分离方法 | 原理 |
A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:实验题
制备水杨酸对正辛基苯基酯( )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按图12所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯,该反应为:
 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑

步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚( ),温度控制在100℃左右,不断搅拌。
),温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是 。
(2)实验时,冷凝管中的水应从 进 出(选填“a”或“b”);装置c的作用是 。
(3)步骤三??发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学可充电池的反应规律(解析版) 题型:选择题
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+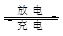 Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是
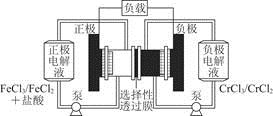
A.充电时,阴极的电极反应式为Cr3++e-=Cr2+
B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+
C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室
D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com