
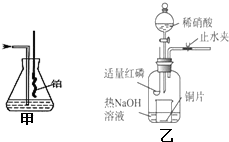
 Ⅰ、实验室模拟氨催化氧化的装置如图甲:
Ⅰ、实验室模拟氨催化氧化的装置如图甲:分析 Ⅰ、(1)混合气体中含有大量的氮气和氢气,均是难溶于水的气体,极易溶于水的气体易发生倒吸;
(2)氨的氧化反应是一个放热反应;生成的一氧化氮与空气中的氧气化合成二氧化氮;
(3)氨的氧化反应生成一氧化氮和水,据此书写方程式;
Ⅱ、装置用来制备NO并验证其还原性,先在无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮,据此解答.
解答 解:Ⅰ、(1)氨气的混合气体中含有大量的氮气和氢气,均是难溶于水的气体,不会倒吸,
故答案为:不会;混合气体中含有大量难溶于水的氮气和氢气;
(2)氨的氧化反应是一个放热反应,放出的热使铂丝保持红热,生成的一氧化氮与空气中的氧气化合成二氧化氮,二氧化氮是红棕色气体,故答案为:氨的氧化反应是一个放热反应,放出的热使铂丝保持红热;有红棕色气体产生;
(3)氨的催化氧化反应方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
Ⅱ、装置用来制备NO并验证其还原性,先制备无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮,
(4)由上述分析可知,步骤c后还缺少的一步主要操作是:打开止水夹,通入少量氧气,故答案为:打开止水夹,通入少量氧气;
(5)步骤c滴入稀硝酸后烧杯中,发生反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,现象是:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,
故答案为:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题以信息形式主要考查了氮气的制取、以及氮的化合物的性质,综合性较大,旨在考查学生对知识的迁移运用,注意一氧化氮的制备应在没有氧气条件下进行.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 范德华力是普遍存在的一种分子间作用力,属于电性作用 | |
| B. | 范德华力比较弱,但范德华力越强,物质的熔点和沸点越高 | |
| C. | 氢键属于一种较强的分子间作用力,只能存在于分子之间 | |
| D. | 形成氢键时必须含有氢原子,另外氢原子两边的原子必须具有很强的电负性、很小的原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 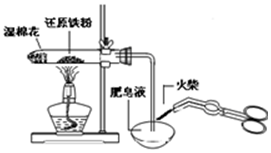 检验铁粉与水蒸气反应产生的氢气 检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量纯净干燥的氨气 快速制备和收集一定量纯净干燥的氨气 | |
| C. |  分离互溶但沸点相差大的液体混合物 | |
| D. |  除去甲烷中少量的乙烯得纯净甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的电子式: | |
| B. | 氯原子的结构示意图: | |
| C. | 氢氧根离子的电子式: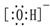 | |
| D. | 质量数为146、中子数为54的铀(U)原子:${\;}_{54}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.5% | B. | 大于7.5%. | C. | 小于7.5% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3、NaCl、K2SO4 | B. | KCl、NaOH、CuSO4 | ||
| C. | BaCl2、NaOH、H2SO4 | D. | FeCl3、Na2SO4、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
| A. | ①④ | B. | ②③ | C. | 只有① | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )| A. | HA为强酸 | B. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | 图中X表示HA,Y表示H+,Z表示OH- | D. | 该混合液pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com