
【题目】(1)硼酸(H3BO3)是一种白色固体,可溶于水,其水溶液为一元弱酸。硼酸分子中硼原子的杂化类型为______________;写出硼酸在水溶液中电离方程式 +H2O
+H2O![]() _______。
_______。
(2)CS2、NO2+具有相同的通式AX2,它们的价电子总数都是16。 CO32-、NO3-等微粒具有相同的通式:_______,它们的价电子总数是______________,因此它们与由第VIA族两元素组成的___________________(填分子式)分子结构相同,呈______形。
(3)一个尿素[CO(NH2)2]分子中含有______个![]() 键;1 mol化合物Fe(CO)5分子中所含
键;1 mol化合物Fe(CO)5分子中所含![]() 键数目为_________。
键数目为_________。
【答案】 sp2 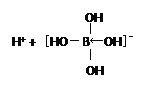 (或H+ + H4BO4-) AX3 24 SO3 平面三角形 7 10NA
(或H+ + H4BO4-) AX3 24 SO3 平面三角形 7 10NA
【解析】试题分析:(1)B原子最外层有3个电子,以3个共价键与3个羟基结合;硼酸本身不能电离出氢离子,而硼酸与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-),因而溶液呈酸性;(2)CO32-、NO3-等微粒中心原子与氧原子的个数比是1:3;价电子总数是各原子最外层电子数与离子所带电荷的差。VIA族两元素组成的原子的个数比是1:3的化合物是SO3;SO3的价电子对数为3,无孤对电子,根据价电子理论分析空间构型;(3)根据分子结构分析σ键数。
解析:(1)B原子最外层有3个电子,以3个共价键与3个羟基结合,B原子价电子对数为3,所以硼酸分子中硼原子的杂化类型为sp2;硼酸本身不能电离出氢离子,而硼酸与H2O电离出的OH-结合形成配位键,从而破坏了水的电离平衡,使c(H+)>c(OH-),硼酸在水溶液中电离方程式 +H2O
+H2O![]()
 ;
;
(2)CO32-、NO3-等微粒中心原子与氧原子的个数比是1:3,通式是AX3;价电子总数是各原子最外层电子数与所带电荷的差,CO32-、NO3-的价电子总数是24。VIA族两元素组成的原子的个数比是1:3的化合物是SO3;SO3中S原子的价电子对数为3,无孤对电子,空间构型是平面三角形;(3)CO(NH2)2分子中有2个C-N、4个N-H和1个C=O,所以CO(NH2)2分子有7个σ键;Fe(CO)5分子中有5个C![]() O,5个Fe、C结合的配位键,所以1 mol化合物Fe(CO)5分子中所含
O,5个Fe、C结合的配位键,所以1 mol化合物Fe(CO)5分子中所含![]() 键数目为10NA。
键数目为10NA。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B两种液体,一瓶是植物油,一瓶是矿物油。现各取少量,放在两只洁净的试管里,加入NaOH溶液并加热,冷却后加水振荡,A出现泡沫,B无明显现象。由此可推出,A为_______,B为________;理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空
(1)下列原子:126C、147N、2311Na、31H、23592U、4019K、23892U中有种元素,和互为同位素.
(2)某阴离子的中子数为N,若AXa﹣共有x个电子,则N= .
(3)已知拆开1molH﹣H键、1molN≡N、1molN﹣H键分别需要吸收的能量为436KJ、946KJ、391KJ.则由N2和H2反应生成2mol NH3需要(选填“放出”或“吸收”)KJ的热量.
(4)下列曲线分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中: 
①第ⅡA族元素的最外层电子数;
②第三周期元素的最高化合价;
③碱金属单质的熔点 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 30 g乙烷中所含的极性共价键数为7NA
B. 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA
C. 1 L浓度为1 mol·L-1的 H2O2水溶液中含有的氧原子数为2NA
D. MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯的说法不正确的是( )
A. 无色气体,难溶于水,密度比空气略小 B. 与溴水发生取代反应而使溴水退色
C. 乙烯的产量标志着一个国家的石油化工水平 D. 乙烯燃烧时,火焰明亮,同时伴有黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL0.1mol/LA1C13 溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A. 甲中沉淀一定比乙中多 B. 乙中沉淀可能比甲中的多
C. 甲中沉淀一定比乙中的少 D. 甲中和乙中的沉淀可能一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的试剂或用品正确的是
A.除去淀粉溶液中少量的NaCl:半透膜
B.除去CO中混有的少量O2:灼热的Cu网
C.除去CO2中混有的少量SO2:饱和Na2CO3溶液
D.除去MgCl2溶液中少量的FeCl2:氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 为中学常见单质,其中一种为金属;通常情况下,A 为固体,B 为液体,C 为气体。D、 E、F、G、H、X 均为化合物,其中 X 是一种无氧强酸、E 为黑色固体,H 在常温下为液体。它们之间的 转化关系如图所示(其中某些反应条件和部分反应物已略去)。

(1)写出化学式:A____________、D__________、E__________、X________。
(2) 在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3) 反应⑥的离子方程式为__________。
(4)反应⑦的化学方程式为__________,该反应中每消耗 0.3molA,可转移电子__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡结构松散,不能用于制造器皿;而白锡结构坚固,可以制造器皿。己知0℃、101 kPa时Sn(白,s)=Sn(灰,s)△H= -2180.9 J·mol-1,△S=- 6.61 J·mol-1·K-1。假设△H和△S不随温度的改变而改变,现把白锡制造的器皿放在室温下存放,它会不会变成灰锡而不能继续使用 ( )
A. 会变 B. 不会变 C. 不能确定 D. 升高温度才会变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com