
| A. | 3-甲基丁烷 | B. | 1,1,3-三甲基戊烷 | ||
| C. | 2,2,4,4-四甲基辛烷 | D. | 4-丁烯 |
分析 A、丁烷命名中出现3-甲基,说明选取链端错误;
B、烷烃命名中出现1-甲基,说明选取的不是最长碳链;
C、烷烃命名原则“长、多、近、小、简”;
D、烯烃命名中选取距离碳碳双键最近的一端为1号碳.
解答 解:A、3-甲基丁烷,1号碳位置错误,正确命名应为:2-甲基丁烷,故A错误;
B、1,1,3-三甲基戊烷,链端错误,正确命名应为:2,4-二甲基己烷,故B错误;
C、2,2,4,4-四甲基辛烷,符合烷烃的命名原则,故C正确;
D、4-丁烯,选取链端错误,正确命名应为:1-丁烯,故D错误,故选C.
点评 本题主要考查的是烷烃与烯烃的命名,烷烃命名中选取最长碳链为主链,烯烃命名中选取含有碳碳双键的最长碳链为主链,为常考题,难度不大.


科目:高中化学 来源: 题型:解答题
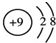
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 ⑤H2O和H2O2
⑤H2O和H2O2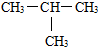 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
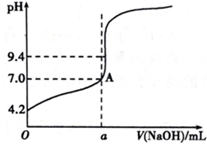 现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:
现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:| 滴定次数 | 1 | 2 | 3 | 4 |
| V(标准溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、D不可能在同周期 | B. | C和D的单质可能化合为离子化合物 | ||
| C. | A、D可能在同一主族 | D. | D一定在第二周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯和苯都可以从化石燃料中提取,都能使溴水因发生化学反应而褪色 | |
| B. | 乙烯和苯分子中因都存在C═C,因为都能发生加成反应和氧化反应 | |
| C. | 酸性KMnO4溶液既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 | |
| D. | 只用一种试剂就可以鉴别乙醇、乙酸、四氯化碳、苯四种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
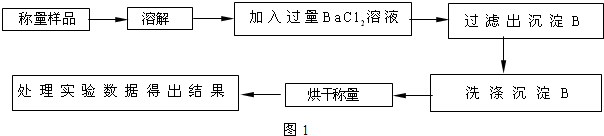
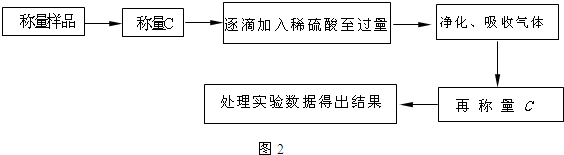
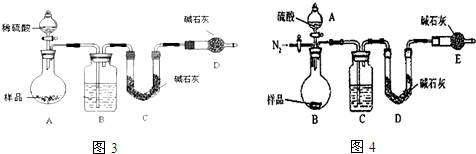
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -870.3KJ•mol-1 | B. | -571.6KJ•mol-1 | C. | +787.0KJ•mol-1 | D. | -488.3KJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com