
| A. | K+,HCO3-,Cl-,Na+ | B. | Mg2+,NH4+,Cl-,NO3- | ||
| C. | Ba2+,Cu2+,OH-,Cl- | D. | Na+,SO42-,Cu2+,NO3- |
科目:高中化学 来源: 题型:选择题
| A. | ②③① | B. | ③② | C. | ②①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
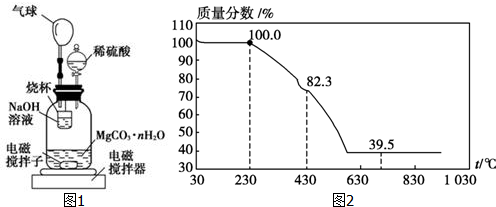
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO32-+2CO2+2H2O→H2SiO3+2HCO3- | |
| B. | SiO2+2C$\stackrel{高温}{→}$Si+2CO↑ | |
| C. | SiH4$\stackrel{500℃}{→}$Si+2H2;CH4$\stackrel{>1000℃}{→}$C+2H2 | |
| D. | Si+O2$\stackrel{900℃}{→}$SiO2;C+O2$\stackrel{300℃}{→}$CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应为还原反应 | B. | 含有氧元素的物质是氧化剂 | ||
| C. | 还原剂是化合价升高的物质 | D. | 氧化剂和还原剂不可能是同一物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 约等于3.55g | B. | 小于3.55g | C. | 大于3.55g | D. | 约等于7.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和甲苯都能使酸性KMnO4溶液褪色 | |
| B. | 乙醚和乙酸都能与H2发生加成反应 | |
| C. | 蛋白质、油脂和糖类都可发生水解 | |
| D. | 乙醇和乙酸乙酯使用饱和Na2CO3溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com