
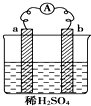
| A. | 反应后a极质量减小 | |
| B. | 碳棒上有气体逸出 | |
| C. | 导线上有电流,电子流动方向从a→b | |
| D. | a极上发生还原反应,b极上发生氧化反应 |
分析 根据装置没有电源,则构成原电池装置,又a在金属活动性顺序表中排在氢之前,b为碳棒,则a为负极本身失电子发生氧化反应,b为正极溶液中的氢离子得电子发生还原反应,电子从负极流向正极,据此分析.
解答 解:A.根据装置没有电源,则构成原电池装置,又a在金属活动性顺序表中排在氢之前,b为碳棒,则a为负极本身失电子发生氧化反应,所以a极质量减小,故A正确;
B、b为正极溶液中的氢离子得电子发生还原反应,所以碳棒上有气体逸出,故B正确;
C、电子从负极流向正极,即从a→b,故C正确;
D、a为负极本身失电子发生氧化反应,b为正极溶液中的氢离子得电子发生还原反应,故D错误;
故选D.
点评 本题考查原电池原理,明确正负极上得失电子是解本题关键,难度不大,注意对基础知识的归纳整理.


科目:高中化学 来源: 题型:选择题
| A. | 提高反应物的利用率 | B. | 改变平衡混合物的组成 | ||
| C. | 以同样程度改变正逆反应的速率 | D. | 增大正反应速率,减小逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷在通常状况下是固体 | B. | 可以有-3、+3、+5等多种化合价 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 砷的还原性比磷弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属(相同粉末状) 和物质的量(mol) | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Fe | 0.1 | 3mol/L HCl | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Cu | 0.1 | 4mol/L H2SO4 | 10 | 20℃ |
| D | Mg | 0.1 | 稀6mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸、硝酸的设备中安装热交换器 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| D. | 用废铜屑制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
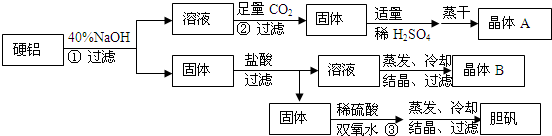
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
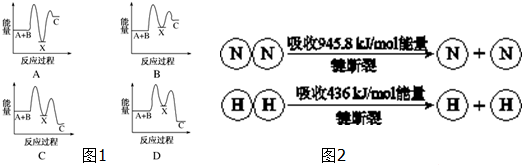
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com