
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 放出热量a kJ | |
| ② | 2 | 3 | 放出热量b kJ | |
| ③ | 2 | 6 | 放出热量c kJ | |


科目:高中化学 来源: 题型:
 (2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5,
(2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5, HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH- HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-| cc(Z) |
| ca(X)?cb(Y) |
| cc(Z) |
| ca(X)?cb(Y) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省东台市唐洋中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ;加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)
cZ(g)
右图是不同温度下反应达到平衡时,反应混合物中Z的体积分数 和压强关系示意图。
① 写出该反应的化学平衡常数表达式:K= 。随着温 度的升高,K值 (填“增大”、“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (字母填序号)。
| A.X的转化率越高 | B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 | D.化学反应速率越快 |

查看答案和解析>>
科目:高中化学 来源:2014届江苏省东台市高二下学期期中考试化学试卷(解析版) 题型:填空题
(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ;加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)
cZ(g)
右图是不同温度下反应达到平衡时,反应混合物中Z的体积分数 和压强关系示意图。

① 写出该反应的化学平衡常数表达式:K= 。随着温 度的升高,K值 (填“增大”、“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (字母填序号)。
A.X的转化率越高 B.反应进行得越完全
C.达到平衡时X的浓度越大 D.化学反应速率越快
② 如右图所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲乙两容器的初始体积均为1L,甲、乙容器达到平衡所用时间:甲 乙(填“>”、“<”或“=”,下同),平衡时X和Y的转化率:甲 乙。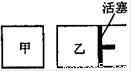
查看答案和解析>>
科目:高中化学 来源:2014届山东省济宁市高一3月月考化学试卷 题型:选择题
相同温度下,在两个等体积的密闭容器中,分别充入氦气、氮气两种气体,当它们的密度相同时,则氦气和氮气的物质的量之比是( )
A.7:2 B.2:7 C.1:7 D.7:l
查看答案和解析>>
科目:高中化学 来源:2012届云南省高二年级下学期期中考试化学试卷 题型:选择题
相同温度下,在两个等体积的密闭容器中,分别充入氦气、氮气两种气体,当他们的密度都相同时,这两种气体的物质的量之比是
A、1 : 7 B、2 : 7 C、7 : 1 D、7 : 2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com