
| A. | Al 是地壳中含量最多的金属元素 | |
| B. | Al 是比较活泼的金属,在化学反应中容易失去电子,表现还原性 | |
| C. | 实验室里常用铝盐溶液与氢氧化钠反应来制备氢氧化铝 | |
| D. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
分析 铝含量丰富,为地壳中含量最多的金属元素,性质活泼,对应的氧化物、氢氧化物为两性物质,可与强碱、强酸反应,氧化铝的熔点比铝高,以此解答该题.
解答 解:A.地壳中元素含量最高的是氧元素,铝是地壳中元素含量最高的金属元素,故A正确;
B.在金属活动顺序表中铝在氢之前,性质活泼,在化学反应中容易失去电子,表现还原性,故B正确;
C.因氢氧化铝为两性氢氧化物,易与强碱反应,则制备氢氧化铝应用弱碱,故C错误;
D.铝和氧气反应在Al箔表面生成了致密的氧化铝膜,氧化铝的熔点高于铝的熔点,加热铝箔的时铝熔化了,但是氧化铝膜兜着熔化的铝不会滴落,故D正确.
故选C.
点评 本题考查铝的性质等,难度较小,注意铝、铁与浓硫酸、浓硝酸的钝化现象,是在常温下,发生化学反应,生成一层致密的氧化物保护膜,阻止内部金属与酸继续反应,本题注意氢氧化铝的两性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| B. | 将SO2气体通入澄清石灰水中,石灰水变浑浊,继续通入SO2,浑浊不消失 | |
| C. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
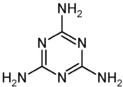 2008年9月11日,有媒体报道,甘肃14名婴儿患肾结石,省卫生厅介入调查,初步认为可能与某品牌奶粉有关.随后,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉收到三聚氰胺污染,并宣布召回市面上被污染的产品.质检总局,卫生部等有关部门随即展开调查.三聚氰胺的分子结构如图,有关三聚氰胺的说法正确的是( )
2008年9月11日,有媒体报道,甘肃14名婴儿患肾结石,省卫生厅介入调查,初步认为可能与某品牌奶粉有关.随后,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉收到三聚氰胺污染,并宣布召回市面上被污染的产品.质检总局,卫生部等有关部门随即展开调查.三聚氰胺的分子结构如图,有关三聚氰胺的说法正确的是( )| A. | 三聚氰胺属于芳香族化合物,但不属于芳香烃 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 三聚氰胺中的碳原子属于饱和碳原子 | |
| D. | 三聚氰胺分子中的所有原子都在一个平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷元素位于元素周期表的第三周期、第ⅤA族 | |
| B. | 磷原子不如氮原子和硫原子的得电子能力强 | |
| C. | 磷的最高价氧化物对应水化物酸性比硫酸强 | |
| D. | 磷的氢化物受热时不如氮的氢化物和硫的氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O和Na2O2中阴阳离子个数比都为1:2 | |
| B. | 钠离子和钠原子都具有较强的还原性 | |
| C. | 钠能把钛锆等金属从它们的盐溶液中还原出来 | |
| D. | NaHCO3的热稳定性强于Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
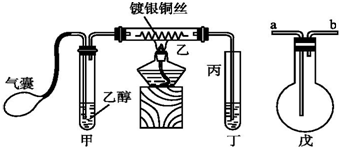
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | ||
| Z |
| A. | X,Y,Z中X的单质最稳定 | |
| B. | Y的氢化物为HY | |
| C. | Z能生成HZO3 | |
| D. | X、Y、Z三种元素中,非金属性最强的元素Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com