
| A. | 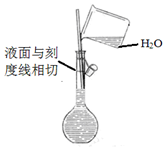 配制溶液 | B. | 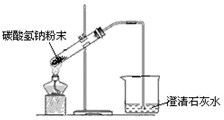 碳酸氢钠受热分解 | ||
| C. | 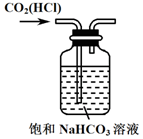 除去CO2中的HCl | D. | 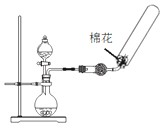 制备收集干燥氨气 |
分析 A.配制溶液时,当液面里刻度线1-2cm时改用胶头滴管;
B.试管口应略朝下倾斜;
C.氯化氢与碳酸氢钠反应生成二氧化碳;
D.导管应插入试管底部.
解答 解:A.配制溶液时,当液面里刻度线1-2cm时改用胶头滴管,以防止压面超过刻度线,故A错误;
B.试管口应略朝下倾斜,防止冷却水使试管炸裂,故B错误;
C.氯化氢与碳酸氢钠反应生成二氧化碳,可用于除去氯化氢,故C正确;
D.氨气密度比空气小,导管应插入试管底部,用向下排空法收集,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液的配制、氨气的制备实验等,把握实验基础知识和装置图的作用为解答的关键,注意实验的评价性、操作性分析,题目难度不大.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:实验题
 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 项目 数据 次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值 (T2-T1)/℃ | ||
| H2SO4 | KOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
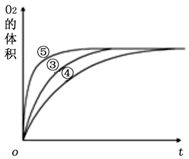
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol•L-1 X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2=CHCOOH能发生加成、取代、氧化反应 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 | |
| D. | 甲苯和乙烯都可与溴水发生化学反应使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
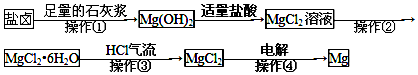
| A. | 操作①--③是为了获得无水氯化镁 | |
| B. | 操作④发生了氧化还原反应 | |
| C. | 操作②是冷却结晶 | |
| D. | 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.6gNH2-离子含有的电子数为NA | |
| B. | 20℃、1.0×105Pa时,11.2 L氧气所含的原子数为NA | |
| C. | 标准状况下,2.24LCHCl3含有的共价键数为0.42 NA | |
| D. | 1L 2mol•L-1的硝酸镁溶液中含有的硝酸根离子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com