

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
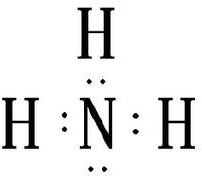 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 航天服材质是由碳化硅/陶瓷和碳纤维等复合而成,具有耐高温防寒等性能 | |
| B. | 从海水提取物质不一定都必须通过化学反应才能实现 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 明矾可用于自来水的净化,氯气可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
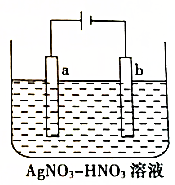 如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Fe2(SO4)3溶液中加入过量的铁粉,过滤,在滤液中加入过量的NaOH溶液 | |
| B. | 用铁粉与稀硫酸充分反应,然后再加入过量的氨水 | |
| C. | 在FeCl2溶液上加一层苯,然后将滴管插入到FeCl2溶液液面以下,慢慢滴加NaOH溶液(溶液中不能有气泡,配制FeCl2和NaOH溶液的蒸馏水必须加热煮沸) | |
| D. | 在生成Fe(OH)3的悬浊液中加过量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
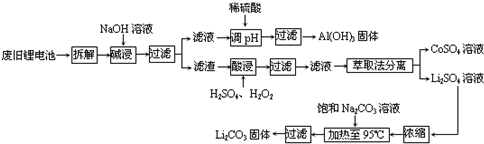
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
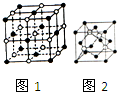 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.| NaF | NaCl | NaBr | NaI | |
| 熔点/℃ | 993 | 801 | 747 | 661 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com