
 NH4++NH2—的电离平衡关系,两离子的平衡浓度均为1×10—15mol/L,下列对-50℃时液氨的离子积表达正确的是
NH4++NH2—的电离平衡关系,两离子的平衡浓度均为1×10—15mol/L,下列对-50℃时液氨的离子积表达正确的是 | A.离子积是1.0×10—30 |
| B.离子积是1.0×10—15 |
| C.若液氨中加入NaNH2,其离子积增大 |
| D.若液氨中加入NH4Cl,则[NH4+]增大,离子积数值增加 |
科目:高中化学 来源:不详 题型:单选题
| A.溶液的pH值变小 |
| B.醋酸的电离程度降低 |
| C.溶液的导电能力减弱 |
| D.中和此溶液所需的0.1mol/LNaOH溶液的体积增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.1% | B.1.5% | C.0.5% | D.0.1% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 下列叙述正确的是 ( )
下列叙述正确的是 ( )| A.0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32->c(H+)>c(OH-) |
| B.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)前者大于后 |
| C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HNO2溶液做导电实验,灯泡很暗; | B.0.1 mol/L HNO2溶液的pH=2.1 |
| C.HNO2不是离子化物,而是共价化合物 | D.HNO2和NaCl不能发生反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是| A.加少量CH3COONH4固体 | B.降低温度 | C.加少量NaCl固体 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的醋酸溶液加水稀释时,下列说法正确的是( )
的醋酸溶液加水稀释时,下列说法正确的是( ) | A.溶液中氢氧根离子的浓度增大了 |
B.c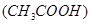 减小,电离平衡向生成醋酸分子的方向移动? 减小,电离平衡向生成醋酸分子的方向移动? |
| C.平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少 |
D.电离程度增大,c 也增大了 也增大了 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3 |
| B.25oC时CH3COONa溶液的Kw大于100OC时CH3COONa溶液的Kw |
| C.100OC时,将PH=2的盐酸与PH=12的NaOH溶液等体积混合,溶液呈中性 |
| D.一般而言,弱电解质的浓度越大,其电离度越小,电离常数也越小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com