
在一定温度和压力下,某一定量的PCl5气体的体积为1 L,此时PCl5气体已有50%离解为PCl3和Cl2,试判断在下列情况下,PCl5的离解度是增大还是减小?
(1)减小压力使PCl5的体积变为2 L;
(2)保持压力不变,加入氮气使体积增至2 L;
(3)保持体积不变,加入氮气使压力增加1倍;
(4)保持压力不变,加入氯气,使体积变为2 L;
(5)保持体积不变,加入氯气,使压力增加1倍。
分析:判断PCl5离解度的增减,实质上是判断平衡PCl5(g)![]() PCl3(g)+ Cl2在不同条件下的移动方向,若平衡向右移动,PCl5的离解度增大;若平衡向左移动,PCl5的离解度减小。
PCl3(g)+ Cl2在不同条件下的移动方向,若平衡向右移动,PCl5的离解度增大;若平衡向左移动,PCl5的离解度减小。
判断平衡移动的方向,首先要知道现在平衡的平衡常数,并要计算不同条件下的浓度商QC(在此应为压力商QP),比较QP和压力常数KP的关系进行判断。若QP = KP时,平衡不移动,若QP < KP时,平衡右移,若QP > KP时,平衡左移。
解:PCl5(g) ![]() PCl3(g)+ Cl2(g)
PCl3(g)+ Cl2(g)
已知50%的PCl5分解,所以在平衡时,PCl5、PCl3、Cl2的平衡分压相等,设为p。
则平衡常数 KP = ![]() =
= ![]() = p
= p
(1)体积增大了1倍,各物质的分压均减小1倍,所以此时
QP = ![]() =
=  =
= ![]() p < KP
p < KP
故平衡向右移动,PCl5的离解度增大。
(2)加入氮气,氮气虽然不参加反应,但它使体系的体积增大1倍,因而使PCl5、PCl3和Cl2的分压均减小1倍,所以结果同(1)。
(3)加入氮气,虽然使压力增加1倍,但由于体积未变,因此PCl5、PCl3和Cl2的分压不变,化学平衡不移动,所以PCl5的离解度不变。
(4)加入氯气,使体积变为2 L,总的压力不变,仍为3p,但各物质的分压为:
p![]() = p
= p![]() =
= ![]() p
p
p![]() = 3p - p
= 3p - p![]() - p
- p![]() = 3p - p = 2p
= 3p - p = 2p
QP = ![]() =
= 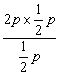 = 2p > KP
= 2p > KP
所以平衡向左移动,使PCl5的离解度减小。
(5)体积不变增加氯气使压力增加1倍,此时的总压力为2×3p = 6p,各物质的分压为:
p![]() = p
= p![]() = p
= p
p![]() = 6p - p- p = 4p
= 6p - p- p = 4p
QP = ![]() =
= ![]() = 4p > KP
= 4p > KP
平衡向左移动,减小了PCl5的离解度。


科目:高中化学 来源: 题型:021
在一定条件下,进入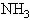 合成塔的混合气体中含
合成塔的混合气体中含 的体积分数为22%,含
的体积分数为22%,含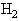 的体积分数为78%,经过合成反应达到平衡后,在相同的温度和压力下气体的体积缩小至原体积的95%,
的体积分数为78%,经过合成反应达到平衡后,在相同的温度和压力下气体的体积缩小至原体积的95%, 的转化率跟下面哪一个数值接近.
的转化率跟下面哪一个数值接近.
[
]A
.12.5% B.11.5% C.10.5% D.9%查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中含有NOx、CO及碳氢化合物,直接排入空气会造成大气污染,某研究性学习小组拟探究汽车尾气相关问题,请你参与并回答问题。
(1)有人建议汽车尾气中的CO,可用加入催化剂催化热分解的方法消除。已知热分解反应
CO(g)=c(s)+O2(g)的△H=+110.5kJ/mol,△S=-0.089kJ·mol-1.K-1,这一方案理论上是否可行,____________(选填:“可行”或“不可行”)。
![]() (2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。
(2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。
①上述反应的平衡常数表达式为:_________________________。
②下列有关说法正确的是_____________________________
A.减少CO和NO浓度的有效方法是加长汽车尾气排气管的长度
B.提高NO及CO转化率的有效方法是低温催化
C.汽车尾气中的NO主要是由于石油中含有大量的氮元素
D.使用催化剂,在适当温度和压力下有利干提高上述反应转化效率
(3)测定汽车尾气中NO,NO2的方法之一,用3%的H2o2溶液吸收生成HNO3,再用NaOH标准溶液滴定。若要确定尾气中NO,NO2体积分数总和,所需的数据有___________(选填序号)。
A.气体样品的体积 B.NaOH标准溶液的浓度及所消耗的体积
C.从滴定开始到指示剂变色所需的时间 D.两种氮氧化物的体积比
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
已知理想气体各参数p(压强)、V(体积)、T(温度)、n(物质的量)满足理想气体状态方程pV=nRT。某学校课外活动小组粗略测定理想气体状态方程中气体常数R的值,下面是测定实验的分析报告,请填写有关空白:
(一)测定原理:在理想气体状态方程pV=nRT中,气体常数R=pV/nT的数值可以通过实验来确定。本实验通过金属镁置换出盐酸中的氢来测定R的值。其反应为:
Mg+2HCl=MgCl2+H2↑
如果称取一定质量的镁与过量的盐酸反应,则在一定温度和压力下,可以通过测出反应放出氢气的体积。实验室的温度和压力可以分别由温度计和气压计测得。氢气物质的量可以通过反应中镁的质量来求得。将以上所得各项数据代入R= pV /nT式中,即可算出R值。
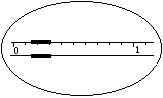 (二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(三)实验内容:
1.在托盘天平上称出镁条的质量(称量镁条天平的游码示数如右图所示,未用砝码,单位为g);
2.按上图搭好仪器。取下试管,移动量气管B,使量气管A中的水面略低于零刻度线,然后将量气管B固定。
3.在试管中加入15mL 6 mol·L-1HCl,不要使盐酸沾湿试管的上半部。将已称重的镁沾少许水,贴在试管上部不与盐酸接触。
4.检查仪器是否漏气,方法如下:(方法要求简单有效)
。
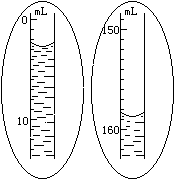 5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
6.轻轻摇动试管,使镁条落入盐酸中,镁条与盐酸反应放出氢气。此时量气管A内水面即开始下降。为了不使量气管A内气压增大而造成漏气,在量气管A内水面下降的同时,慢慢 (上或下)移量气管B,使两管内的水面基本保持水平。反应停止后,待试管冷却至室温(约10分钟),移动量气管B,使两管内的水面相平,读出反应后量气管A内的精确读数V2(如右图所示)。
7.记录实验时的室温t和大气压P。(已知室温为27℃,大气压为100kPa)
(四)数据记录与处理(在横线上填写适当内容):
| 镁条的质量 | w= |
| g |
| 氢气的物质的量 | n= |
| mol |
| 反应前量气管A内读数 | V1= |
| ml |
| 反应后量气管A内读数 | V2= |
| ml |
| 氢气的体积 | V |
| ml |
| 室温 | T |
| K |
| 大气压 | P |
| Pa |
气体常数R的值(计算过程和结果):
(五)问题与讨论:①在读取量气管内气体体积V1时,眼睛仰视读数,结果造成R的测定值 (偏高、偏低或无影响);②若没等反应试管冷却到室温就量取液面的高度,结果造成R的测定值 (偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com