
 ;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.
;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.分析 A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则A为O元素;B和C的原子序数之和是A的原子序数的3倍,B、C原子序数之和为24,B和C形成的离子具有相同的电子层结构,可推知B为Na、C为Al,据此解答.
解答 解:A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则A为O元素;B和C的原子序数之和是A的原子序数的3倍,B、C原子序数之和为24,B和C形成的离子具有相同的电子层结构,可推知B为Na、C为Al.
(1)C离子为Al3+,Al3+的结构示意图是 ,由A和B形成的原子个数为1:1的化合物为Na2O2,阴阳离子数目之比为1:1,
,由A和B形成的原子个数为1:1的化合物为Na2O2,阴阳离子数目之比为1:1,
故答案为: ;1:1;
;1:1;
(2)B、C离子分别为Na+、Al3+,电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+>Al3+,B和C元素最高价氧化物的水化物分别为NaOH、Al (OH)3,二者反应的离子方程式为:OH-+Al (OH)3=AlO2-+2H2O,
故答案为:>;OH-+Al(OH)3=AlO2-+2H2O;
(3)化合物X由元素A、B、C组成,则X为NaAlO2,NaAlO2溶液与过量盐酸反应的离子方程式为AlO2-+4H+=Al3++2H2O,故答案为:AlO2-+4H+=Al3++2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重化学用语与元素化合物知识的考查,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
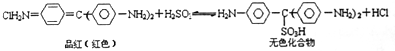
| A. | 品红溶液中同时通入Cl2、SO2,漂白效果会更好 | |
| B. | 加热可判断品红褪色是通入SO2还是通入Cl2引起的 | |
| C. | “无色化合物”分子中,19个碳原子都可能在同一平面上 | |
| D. | 无色化合物中的官能团有苯环、磺酸基、氨基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷的外围电子排布式:3d104S24p3 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: | |
| D. | 过氧化钠的电子式: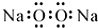 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、Cl-、NO3- | B. | Na+、Al3+、SO42-、Cl- | ||
| C. | NH4+、K+、NO3-、S2- | D. | Na+、K+、HCO3-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两元素必在同一周期 | B. | 两元素可能在相邻两周期 | ||
| C. | 两元素不可能同为金属元素 | D. | 两元素不可能同主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com