
����Ŀ��ijѧ���� 0.1000 mol��L��1 �� NaOH ��Һ�ζ� 20.00mL δ֪Ũ�ȵ�ϡ���ᣬ�ζ������ɷֽ�Ϊ���¼��������õ������Ѽ�©�Ҹ�������ˮϴ������
A������ʽ�ζ�������ƿ��ע�� 20.00mL ����ϡ������Һ�������� 2��3 �η�̪��
B���ñ� NaOH ��Һ��ϴ��ʽ�ζ��� 2��3 �Σ�
C����ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ��ܼ���ʹ֮������Һ��ʹ���������ݣ�
D������ NaOH ��Һע���ʽ�ζ������̶� 0 ���� 2��3cm ��
E������Һ���� 0 �� 0 �̶����£����¶�����

F������ƿ���ڵζ��ܵ����棬�ñ� NaOH ��Һ�ζ����յ㲢���µζ���Һ��Ŀ̶ȡ�
��1����ȷ���������˳���ǣ��������ĸ��д��B_______F ��
��2���ζ��ﵽ�յ������_________��
��3���ñ� NaOH ��Һ�ζ�ʱ��Ӧ���� NaOH ��Һע��_____����ͼ�����������������С�
��4���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�_______��
��5�����������ݼ��㣬����������Һ��Ũ��Ϊ ____mol��L��1 (����������С�������λ)
ʵ���� | �������������m L�� | �ζ�ǰ NaOH ��Һ�����������mL�� | �ζ��� NaOH ��Һ �����������mL�� |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
��6�����в����ᵼ�²ⶨ���ƫ�͵���____��
A����ʽ�ζ���δ�ñ� NaOH ��Һ��ϴ��װ��Һ�ζ�
B����ȡ��Һ����ʱ����ǰ���ӣ��ζ����յ����
C���ζ�ǰ��ʽ�ζ��ܼ��촦������δ�ų����ζ���������ʧ
D����ʽ�ζ���û���ô���������ϴ��ֱ��װ���������
���𰸡� DCEA �������һ�α�Һʱ����Һ��ɫ����ɫ��Ϊ�ۺ�ɫ���Ұ�����ڲ���ɫ �� ��ƿ����Һ��ɫ�ı仯 0.1100 BD
����������1���к͵ζ����ռ�©��ϴ�ӡ���ϴ��װҺ���ζ���˳��������ʴ�Ϊ��BDCEAF����3���ζ�ʱ�����������һ�α�Һʱ����Һ��ɫ����ɫ��Ϊ�ۺ�ɫ���Ұ�����ڲ���ɫ����˵���ﵽ�ζ��յ㣻��3������Һ����װ�ڼ�ʽ�ζ��ܣ����ñ� NaOH ��Һ�ζ�ʱ��Ӧ���� NaOH ��Һע�����У���4���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲���ƿ����Һ��ɫ�ı仯����5�����ݱ������ݣ�������������������Һ�������ƽ��ֵ��![]() mL=22.00mL��c(
mL=22.00mL��c(![]() )=
)=![]() =
=![]() =0.1100mol/L����6��A����ʽ�ζ���δ�ñ� NaOH ��Һ��ϴ����װ��ҺŨ��ƫ�ͣ��ζ�ʱ���ĵı�Һ���ƫ����c(
=0.1100mol/L����6��A����ʽ�ζ���δ�ñ� NaOH ��Һ��ϴ����װ��ҺŨ��ƫ�ͣ��ζ�ʱ���ĵı�Һ���ƫ����c(![]() )=
)=![]() ����������Ũ��ƫ�ߣ�ѡ��A��ѡ��B����ȡ��Һ����ʱ����ǰ���ӣ��ζ����յ���ӣ�����ƫС������c(
����������Ũ��ƫ�ߣ�ѡ��A��ѡ��B����ȡ��Һ����ʱ����ǰ���ӣ��ζ����յ���ӣ�����ƫС������c(![]() )=
)=![]() ����������Ũ��ƫ�ͣ�ѡ��Bѡ��C���ζ�ǰ��ʽ�ζ��ܼ��촦������δ�ų����ζ���������ʧ���൱�ڱ�Һ���ƫ����c(
����������Ũ��ƫ�ͣ�ѡ��Bѡ��C���ζ�ǰ��ʽ�ζ��ܼ��촦������δ�ų����ζ���������ʧ���൱�ڱ�Һ���ƫ����c(![]() )=
)=![]() ����������Ũ��ƫ�ߣ�ѡ��C��ѡ��D����ʽ�ζ���û���ô���������ϴ��ֱ��װ��������ᣬ����ҺŨ�ȱ�С�����ĵı�Һ���ƫС������c(
����������Ũ��ƫ�ߣ�ѡ��C��ѡ��D����ʽ�ζ���û���ô���������ϴ��ֱ��װ��������ᣬ����ҺŨ�ȱ�С�����ĵı�Һ���ƫС������c(![]() )=
)=![]() ����������Ũ��ƫ�ͣ�ѡ��Dѡ����ѡBD��
����������Ũ��ƫ�ͣ�ѡ��Dѡ����ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. Ԫ�����ڱ���18�����У�ÿһ��������һ��
B. 34��Ԫ��λ�ڵ�������VA��
C. ֻ��һ��Ԫ����ɵ�����һ���Ǵ�����
D. ͬ��������֮����ת�����ڻ�ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������ԭ��Ӧ�������У���ȷ���ǣ� ��
A.�е��ʲμӵķ�Ӧһ����������ԭ��Ӧ
B.ȼ�շ�Ӧ������������������
C.2Fe+3Cl2�T2FeCl3�� Fe+S ![]() FeS �ɴ˿����ж������ԣ�Cl2��S
FeS �ɴ˿����ж������ԣ�Cl2��S
D.Mg�ڻ�ѧ��Ӧ��ʧȥ2�����ӣ���Al�ڻ�ѧ��Ӧ��ʧȥ3�����ӣ���˻�ԭ��Al��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ΪԪ�����ڱ���һ���֣����а���������(1��2����)��Ԫ�����ڱ����л��е���š������Ԫ��A��I�ڱ��е�λ�ã��ش��������⡣
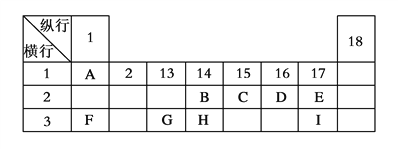
��1��B��C��H��Ԫ���зǽ�������ǿ����________(д��Ԫ������)��д��AF������ĵ���ʽ__________����AF��ˮ��Ӧ����2.24L���壨��״���£�����ת�Ƶ�����ĿΪ_______��
��2������ijԪ�����γ����������д������������������������Һ�����ӷ���ʽ�� ____________��
��3������ijԪ�صĵ����ڳ�����Ϊ��̬����Ԫ������A��I�е�һ��Ԫ�ع���ԭ�Ӹ�����Ϊ1:1��1:2�����ֹ��ۻ�����X��Y����Ԫ�ػ�����A��I�е���һ��Ԫ�ع���ԭ�Ӹ�����Ϊ1:1��1:2���������ӻ�����Z��M��д��Z��Y��Ӧ�Ļ�ѧ����ʽ��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��Ҫ����д��ȷ����( )
A. ��NH4Al(SO4)2��Һ�е�������NaOH��Һ��Al 3+��3OH= A l(OH)3��
B. ���ữ�ĺ����ҽ���Һ����ȡ�⣺2I��H2O2 = I2��2OH
C. ����0.1mol NaOH��0.1mol Na2CO3����Һ�м���1L 0.4mol/L��ϡ����OH��CO32��3H+ = CO2����2H2O
D. ������ˮ����Ϊ����Al(OH)3���壺Al3����3H2O=== A l(OH)3����3H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��У���(In)����ͬ���壬���ͬ���ڡ��ɴ��ƶ�
A.In�������5������B.In��ԭ�Ӱ뾶С��I
C.In(OH)3�ļ���ǿ��Al(OH)3D.In���ڹ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����úת��Ϊ�������ȼ�ϣ�
��֪��2H2(g)+ O2(g)��2H2O(g) ��H= ��483.6kJ/mol
C(s)+1/2O2(g)��CO(g) ��H= ��110.5kJ/mol
д����̿��ˮ������Ӧ�� H2 �� CO ���Ȼ�ѧ����ʽ_____________��
��2��һ���������ܱ������ڣ�SO2 �������� SO3 ���Ȼ�ѧ����ʽΪ��2SO2(g)+O2(g)2SO3(g)��H=��a kJ/mo1������ͬ������Ҫ��ų� 2akJ ��������������ʵ����ʵ���������_______��
A��4mo1 SO2 �� 2mol O2 B��2mol SO2��1mo1O2
C��4mol SO2 �� 4mo1O2 D��6mo1SO2 �� 4mo1O2
��3������β���� NOx �� CO �����ɼ�ת����
����֪���������� NO �ķ�ӦΪ��N2(g)+O2(g) ![]() 2NO(g)����һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����_______��
2NO(g)����һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����_______��
A��ѹǿ���� B���������ƽ����Է�����������
C��2v ��(N2)��v ��(NO) D��N2 ������������ٸı�
������ȼ�Ͳ���ȫȼ��ʱ���� CO���������밴���з�Ӧ��ȥ CO��2CO(g)=2C(s)+O2(g)��H>0�������������ܷ�ʵ�ֵ�����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֹ�������ˮ������ɱ����Ϊ���ƴ��ģ��Ⱦ�Լ�����������Ч����֮һ��Ư���dz��õ���������
��1����ҵ�Ͻ�����ͨ��ʯ����[Ca��OH��2]��ȡƯ�ۣ�Ư�۵���Ч�ɷ��ǣ��ѧʽ���йػ�ѧ��Ӧ����ʽΪ ��
��2��Ư������ˮ���ܿ����е�CO2���ã���������Ư�ס�ɱ�����õĴ����ᣬ��ѧ��Ӧ����ʽΪ ��
��3��O3��Cl2�������Ƶ����ʣ�������������ˮ����������֪����������ʱ������ԭΪ��ͼ�̬������ͬ״����10L O3��L Cl2�����������൱��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ������ ��
A. ����TiCl4Ũ��Һ�Ʊ�TiO2��xH2O��Ti4������x��2��H2O![]() TiO2��xH2O��4H��
TiO2��xH2O��4H��
B. ��NH4��2Fe��SO4��2��Һ�м�������KOH��Һ��NH4+ + OH- == NH3��H2O
C. ��������������ʴʱ��������Ӧ��O2��4H����4e����2H2O
D. ����KI��Һ��ͨ��O2��4H����2I����O2��2H2O��I2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com