
【题目】下列各组离子,在无色、强酸性溶液中能大量共存的是( )
A.Mg2+、K+、SO42﹣、CO32﹣
B.Na+、NO3﹣、Ac﹣、K+
C.Al3+、Na+、Cl﹣、SO42﹣
D.Na+、K+、MnO4﹣、Cl﹣
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为__________________________________。
(2)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A(s)+3B(g)![]() 2C(g)+D(g)来说,下列反应速率最快的是( )
2C(g)+D(g)来说,下列反应速率最快的是( )
A. v(A)=0.02 mol/(Ls) B. v(B)=0.6 mol/(Lmin)
C. v(C)=0.5 mol/(Lmin) D. v(D)=0.01 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。含CN-废水在排放前的处理过程如下:

已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标准状况下密度为1.25g/L的单质气体1.12L。
(1)溶液B具有性质_______________(填“氧化性”或“还原性”)。
(2)写出沉淀D在氧气中灼烧发生的化学方程式___________________________________。
(3)滤液C中还含有微量的CN-离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJmol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
则CO还原Fe2O3(s)的热化学方程式为_____。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H____0(填“>”、“<”或“=”,下同)。
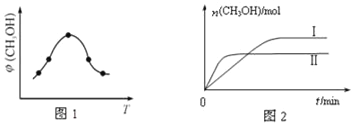
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____KⅡ。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比![]() =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____。
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10﹣5,碳酸一级电离常数Ka=4.3×10﹣7,则NH4HCO3溶液呈_____(填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
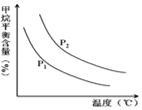
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是
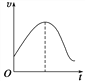
A. 若升高温度,X的体积分数增大,则正反应的△H>0
B. 将容器体积变为20L,Z的平衡浓度变为原来的1/2
C. 以X浓度变化表示的反应速率为0.001mol/(L·s)
D. 若右图纵坐标是正反应速率,则反应应该在绝热条件下进行,图像最高点为平衡点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学与生活的说法错误的是( )
A.铁粉、生石灰均可作食品抗氧化剂
B.明矾、氯化铁均可作净水剂
C.牛奶、鸡蛋清均可用于重金属中毒解毒
D.碘酒、双氧水均可用于伤口消毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com