
| A”¢Ē°2sŅŌN2O4µÄÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ0.01mol/£ØL?s£© |
| B”¢ŌŚ2sŹ±ĢåĻµÄŚµÄŃ¹ĒæĪŖæŖŹ¼Ź±µÄ1.1±¶ |
| C”¢ŌŚĘ½ŗāŹ±ĢåĻµÄŚŗ¬N2O4 0.25mol |
| D”¢Ę½ŗāŹ±£¬N2O4µÄ×Ŗ»ÆĀŹĪŖ40% |
| 0.01mol/L |
| 2s |
| 0.3mol |
| 0.5mol |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢2£ŗ3 | B”¢3£ŗ2 |
| C”¢2£ŗ1 | D”¢1£ŗ2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ||
| ||
| A”¢¢Ł | B”¢¢ŁŗĶ¢Ś |
| C”¢¢ŁŗĶ¢Ū | D”¢¢Ł¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

| A”¢·“Ó¦¢ŁµÄÄę·“Ó¦ŹĒ·ÅČČ·“Ó¦ | ||
| B”¢“ļĘ½ŗā£Ø¢ń£©Ź±ĢåĻµµÄŃ¹ĒæÓė·“Ó¦æŖŹ¼Ź±ĢåĻµµÄŃ¹ĒæÖ®±ČĪŖ11£ŗ10 | ||
C”¢“ļĘ½ŗā£Ø¢ń£©Ź±£¬XµÄ×Ŗ»ÆĀŹĪŖ
| ||
| D”¢ŌŚĘ½ŗā£Ø¢ń£©ŗĶĘ½ŗā£Ø¢ņ£©ÖŠ£¬MµÄĢå»ż·ÖŹżĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ĪļÖŹ | X | Y | Z |
| ³õŹ¼ÅضČ/mol?L-1 | 0.1 | 0.2 | 0 |
| Ę½ŗāÅضČ/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A”¢·“Ó¦“ļµ½Ę½ŗāŹ±£¬yµÄ×Ŗ»ÆĀŹĪŖ75% |
| B”¢·“Ó¦æɱķŹ¾ĪŖX+3Y?2Z£¬ĘäĘ½ŗā³£ŹżĪŖ1600 |
| C”¢Ōö“óŃ¹ĒæŹ¹Ę½ŗāĻņÉś³ÉZµÄ·½ĻņŅĘ¶Æ£¬Ę½ŗā³£Źż²»±ä |
| D”¢øıäĪĀ¶Čµ«²»æÉŅŌøıä“Ė·“Ó¦µÄĘ½ŗā³£Źż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
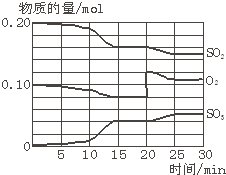
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
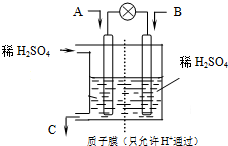 ĖłŅŌ”°µĶĢ¼¾¼Ć”±Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā£®
ĖłŅŌ”°µĶĢ¼¾¼Ć”±Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā£®| ŹµŃé×é | ĪĀ¶Č”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| AӢ0.05 mol?L-1 |
| BӢ0.1 mol?L-1 |
| CӢ0.15 mol?L-1 |
| DӢ0.2 mol?L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ×å ÖÜĘŚ | IA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | ¢ųA |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | S | Cl | Ar |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com