
【题目】所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物![]() 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应
B. 与NaOH水溶液共热
C. 与银氨溶液作用
D. 在催化剂存在下与氢气作用
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是冶炼铜及制备铁氧化物的重要矿藏,常含微量的金、银等.右图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图: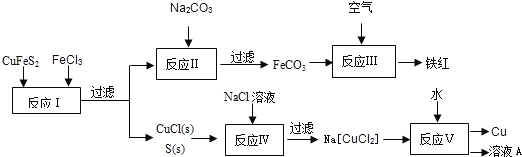
(1)CuFeS2中,Fe的化合价为____________.
(2)写出“反应Ⅰ”的离子方程式___________,该反应的氧化剂是__________.
(3)CuCl难溶于水,但可与过量的Cl-反应生成溶于水的[CuCl2]-.该反应的离子方程式为___.
(4)反应Ⅰ~V五个反应中属于非氧化还原反应的是反应_______(选填“Ⅰ~V”).
(5)已知Cu+在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu,由此可推知“溶液A”中的溶质为____________(写出化学式).
(6)在酸性、有氧条件下,一种叫Thibacillusferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g) + 3H2(g) ![]() 2NH3(g)的化学平衡常数表达式为______。
2NH3(g)的化学平衡常数表达式为______。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反
应固氮的原因是______。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g) + O2(g) | 5×10-31 |
② | N2(g) + 3H2(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下氨的平衡含量如下表。
2NH3(g),在一定条件下氨的平衡含量如下表。
温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
① 该反应为______(填“吸热”或“放热”)反应。
② 其他条件不变时,温度升高氨的平衡含量减小的原因是______(填字母序号)。
a. 温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b. 温度升高,浓度商(Q)变大,Q > K,平衡逆向移动
c. 温度升高,活化分子数增多,反应速率加快
d. 温度升高,K变小,平衡逆向移动
③ 哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是______。
(4)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率______(填“变大”“变小”或“不变”)。
(5)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。下图为电解法合成氨的原理示意图,阴极的电极反应式为______。
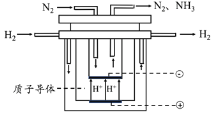
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素![]() 、
、![]() 、
、![]() 、
、![]() ,原子序数依次增大,X原子基态时
,原子序数依次增大,X原子基态时![]() 层中
层中![]() 轨道电子数与s轨道电子数相同;
轨道电子数与s轨道电子数相同;![]() 原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;
原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;![]() 位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
(1)X位于周期表的第_______周期,第______族。
(2)元素的第一电离能:X______Y(填“>”或“<”,下同);原子半径:X______Y。
(3)![]() 的最高价氧化物对应水化物中酸根离子的空间构型是_______(用文字描述)。
的最高价氧化物对应水化物中酸根离子的空间构型是_______(用文字描述)。
(4)![]() 基态核外电子排布式为_________,用铁氰化钾溶液检验
基态核外电子排布式为_________,用铁氰化钾溶液检验![]() 的离子方程式为___________。
的离子方程式为___________。
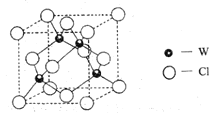
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是_______,它可与浓盐酸发生非氧化还原反应,生成配合物![]() ,反应的化学方程式:_________。
,反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用![]() ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)![]() 的捕集:
的捕集:
①![]() 属于___________分子(填“极性”或“非极性”),其晶体(干冰)属于__________晶体。
属于___________分子(填“极性”或“非极性”),其晶体(干冰)属于__________晶体。
②用饱和![]() 溶液做吸收剂可“捕集”
溶液做吸收剂可“捕集”![]() 。若所得溶液
。若所得溶液![]() ,溶液中
,溶液中![]() _______;(室温下,
_______;(室温下,![]() 的
的![]() )若吸收剂失效,可利用
)若吸收剂失效,可利用![]() 溶液使其再生,写出该反应的离子方程式_____。
溶液使其再生,写出该反应的离子方程式_____。
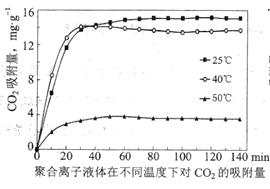
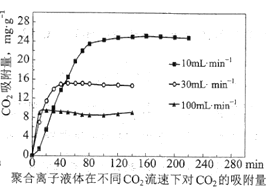
③聚合离子液体是目前广泛研究的![]() 吸附剂。结合下图分析聚合离子液体吸附
吸附剂。结合下图分析聚合离子液体吸附![]() 的有利条件是____________。
的有利条件是____________。
(2)生产尿素:工业上以![]() 、
、![]() 为原料生产尿素
为原料生产尿素![]() ,该反应分为二步进行:
,该反应分为二步进行:
第一步:![]()
![]()
第二步:![]()
![]()
写出上述合成尿素的热化学方程式_______。
(3)合成乙酸:中国科学家首次以![]() 、
、![]() 和
和![]() 为原料高效合成乙酸,其反应路径如图所示:
为原料高效合成乙酸,其反应路径如图所示:
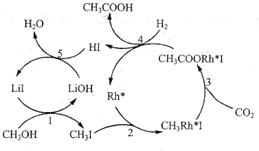
①原料中的可通过电解法由![]() 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成![]() 的电极反应式:____________。
的电极反应式:____________。
②根据图示,写出总反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _____________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是_________________ | ___________ |
③ | 乙炔 | 电石与饱和食盐水反应 | _______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是______________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯(F.Haber)从1902年开始研究由氮气和氢气直接合成氨。合成氨为解决世界的粮食问题作出了重要贡献。其原理为N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol
(1)若已知H-H键的键能为436.0kJ/mol,N-H的键能为390.8kJ/mol,则N![]() N的键能约为_____kJ/mol
N的键能约为_____kJ/mol
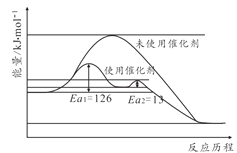
(2)合成氨反应不加催化剂很难发生,催化剂铁触媒加入后参与了反应降低了活化能。其能量原理如图所示,则加了催化剂后整个反应的速率由______决定(填“第一步反应”或者“第二步反应”),未使用催化剂时逆反应活化能______正反应活化能(填“大于”“小于”或者“等于”)
(3)从平衡和速率角度考虑,工业生产采取20MPa到50MPa的高压合成氨原因______
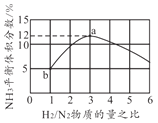
(4)一定温度下恒容容器中,以不同的H2和N2物质的量之比加入,平衡时NH3体积分数如图所示,则H2转化率a点______b点(填"大于”“小于”或者“等于”)。若起始压强为20MPa,则b点时体系的总压强约为______MPa。
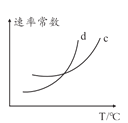
(5)若该反应的正逆反应速率分别表示为v正=K正![]() ,v逆=K逆c2(NH3),则一定温度下,该反应 的平衡常数K=______(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______和______随温度变化趋势(填K正或者K逆)。
,v逆=K逆c2(NH3),则一定温度下,该反应 的平衡常数K=______(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______和______随温度变化趋势(填K正或者K逆)。
(6)常温下,向20mL的0.1mol/L的盐酸中通入一定量氨气反应后溶液呈中性(假设溶液体积变化忽略不计)则所得溶液中c(NH4+)=_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )
A. N2、H2完全转化为NH3 B. N2、H2、NH3在容器中共存
C. 反应已达到化学平衡状态 D. N2、H2、NH3的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用废铁屑(主要成分为Fe2O3、Fe,少量碳) 制取碳酸亚铁(FeCO3) ,设计了如下流程:
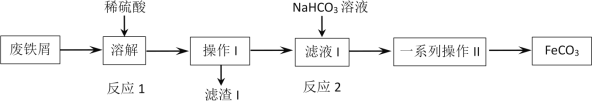
根据以上流程图,下列说法不正确的是( )
A.工业废铁屑往往附着有油脂,可通过热饱和碳酸钠溶液洗涤除去
B.反应2的离子方程式:Fe2++HCO3- = FeCO3↓+H+
C.操作I为过滤,洗涤操作,一系列操作II为过滤,洗涤,干燥
D.为避免硫酸溶解时Fe2+被空气氧化,废铁屑应适当过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com