
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |

分析 I.(1)化学平衡常数为平衡时,生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(2)温度不变,利用浓度商与化学平衡常数的大小,判断平衡移动方向,得到答案;
(3)若已知K350℃<K300℃,说明平衡常数随温度升高减小;
Ⅱ.(4)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(5)分析压强对化学反应速率和化学平衡的影响,得到答案;
(6)电解质能在高温下能传导O2-,负极发生氧化反应,即C8H18)失去电子生成CO2,根据质量守恒和电荷守恒写出电极反应式;
(7)一个电子的电量是1.602×10-19C,当电路中通过1.929×105 C的电量时,电子的个数=$\frac{1.929×1{0}^{5}C}{1.602×1{0}^{-19}C}$=1.204×1024,电子的物质的量=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,根据转移电子和氢氧化钠的关系式计算;
(8)最节能的措施应使用太阳能;原子利用率等于期望产物的总质量与生成物的总质量之比.
解答 解:I.(1)反应物和生成物浓度不变时,达到平衡状态,3min后达到平衡状态,容器体积为1L,则c(H2O)=0.350mol/L,c(CO)=0.150mol/L,c(H2)=c(CO2)=0.600mol/L-0.350mol/L=0.250mol/L,化学平衡常数表达式为:K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.250×0.250}{0.350×0.150}$=1.2,
故答案为:1.2;
(2)向2L恒容密闭容器中充入1mol CO、1mol H2O(g)、2mol CO2、2mol H2,各物质浓度分别为:0.5mol/L、0.5mol/L、1mol/L、1mol/L,浓度商=$\frac{1×1}{0.5×0.5}$=4>1.2,平衡向逆反应方向移动,所以υ(正)<υ(逆),
故答案为:<;
(3)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)?2N2O5(g);若已知K350℃<K300℃,升温平衡逆向进行,则该反应是放热反应,故答案为:放热;
Ⅱ.(4)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$②得反应CO(g)+2H2(g)=CH3OH(l),该反应的反应热△H═-283.0kJ•mol-1+(-286kJ•mol-1)-$\frac{2}{3}$(-726.5kJ•mol-1)=-129kJ•mol-1,CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1;
(5)增加压强,缩小体积,反应物浓度增大,反应速率加快,正反应速率加快大于逆反应速率,化学平衡向正反应方向移动,
故答案为:增加压强使反应速率加快,同时平衡右移,CH3OH产率增大;
(6)电解质能在高温下能传导O2-,负极发生氧化反应,即1molC8H18失去电子生成CO2,共失去8×[+4-(-$\frac{18}{8}$)]=50mole-,18molH原子转化为9molH2O,根据质量守恒和电荷守恒写出电极反应为:C8H18-50e-+25O2-=8CO2+9H2O,
故答案为:C8H18-50e-+25O2-=8CO2+9H2O;
(7)一个电子的电量是1.602×10-19C,当电路中通过1.929×105 C的电量时,电子的个数=$\frac{1.929×1{0}^{5}C}{1.602×1{0}^{-19}C}$=1.204×1024,电子的物质的量=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,根据转移电子和氢氧化钠的关系式得NaOH的质量=$\frac{2mol}{2}×2$×40g/mol=80g,
故答案为:80;
(8)最节能的措施应使用太阳能,以上反应中,最节能的是a,原子利用率等于期望产物的总质量与生成物的总质量之比,反应c中理论上原子利用率为100%,
故答案为:a;100%.
点评 本题考查影响化学平衡的因素、化学平衡的建立等,难度较大,构建平衡建立的途径进行比较是关键;探讨了能源的循环利用和温室效应的解决,着重考查了物质催化反应的过程,结合考查了化学反应速率和对图表的理解解析能力,综合能力要求较高.另外读图时要注意观察横纵坐标的含义和单位.


科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素原子的核外p电子数比s电子数少1.C是电负性最大的元素.D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素.
已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素原子的核外p电子数比s电子数少1.C是电负性最大的元素.D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 向试管中加入2ml溶液 | 实验现象 |
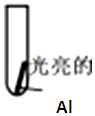 | 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
| 实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
| 实验 | 向试管中加入2mL溶液 | 实验现象 |
 | 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
| 实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
| 实验Ⅵ:0.5mol/LCuSO4溶液+0.02mol NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.10mol•L-1氨水中通SO2:c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3) | |
| B. | 向0.10mol•L-1KHSO3溶液中通NH3:c(K+)>c(SO32-)>c(NH4+) | |
| C. | 向0.10mol•L-1NH4HS溶液中通H2S:c(NH4+)═c(S2-)+c(HS-) | |
| D. | 向0.10mol•L-1Na2C2O4溶液中通HCl:c(Cl-)═c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 污水中所含离子 | H+、OH- | CN- | Cu2+、Hg2+ |
| 处理方法 | 中和法 | 氧化还原法 | 沉淀法 |
| 物质 | Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| Ksp | 2.2×10-20 | 8.5×10 -45 | 6.3×10 -18 | 3.4×10-28 | 4×10-53 | 8×10-29 |
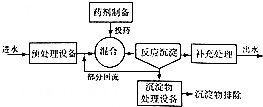
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
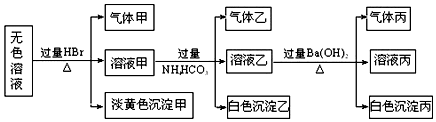
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com