
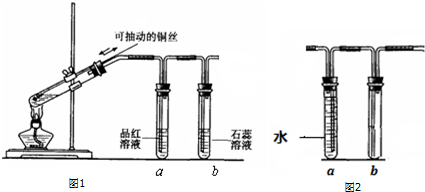
 几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设
几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出方程式;
(2)反应生成的二氧化硫具有漂白性、为酸性氧化物,能够使紫色石蕊溶液变红;
(3)还可以用酸性高锰酸钾溶液检验二氧化硫的还原性、用氢硫酸检验二氧化硫的氧化性;
(4)优点是通过可移动的铜丝,可以控制反应的开始与停止,不足之处是没有尾气吸收装置;
(5)铜与稀硝酸反应生成硝酸铜、一氧化氮气体和水,据此写出反应的离子方程式;通过试管a利用排水法收集NO气体,同时将二氧化氮转化成NO,获得纯净的NO气体.
解答 解:(1)铜浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫为酸性气体,能够使紫色溶液变红色;二氧化硫具有漂白性,能够使品红溶液褪色,则a、b得出的结论为:SO2是一种酸性气体,具有漂白性,能漂白品红,
故答案为:紫色溶液变红色;SO2是一种酸性气体,具有漂白性(能漂白品红);
(3)二氧化硫还具有还原性和氧化性,可用B酸性高锰酸钾溶液验证SO2的还原性,用C氢硫酸验证二氧化硫的氧化性,
故答案为:B,验证SO2的还原性;C,验证SO2的氧化性;
(4)本实验的优点为:使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生;二氧化硫是一种有毒气体,需要用氢氧化钠溶液吸收,所以本实验的不足在于没有尾气吸收装置,改进方法为:把尾气通入氢氧化钠溶液中,
故答案为:使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生;把尾气通入NaOH溶液中;
(5)铜与稀硝酸反应的离子方程式为:3Cu2++8H++2NO3-=3Cu2++2NO↑+4H2O;NO容易与氧气反应生成二氧化氮,所以制取的一氧化氮中会混有部分二氧化氮,通过试管a,可除去NO2,排水法收集纯净的NO,
故答案为:3Cu2++8H++2NO3-=3Cu2++2NO↑+4H2O;除去NO2,排水法收集纯净的NO.
点评 本题考查了浓硫酸的性质、二氧化硫的性质及检验,题目难度中等,注意掌握铜与浓硫酸反应原理、二氧化硫气体的性质及检验方法,试题有利于培养学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲与足量的乙完全反应共转移了1 mol电子 | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 原子半径:W>Z>Y>X | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子总的物质的量小于0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
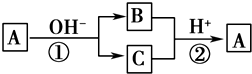 A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列说法正确的是( )
A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列说法正确的是( )| A. | 反应①和②互为可逆反应 | B. | X元素可能为铝 | ||
| C. | X元素可能是金属,也可能是非金属 | D. | 反应①和②一定为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O | |
| B. | 在NaHSO4溶液中加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸:2OH-+CO32-+4H+=CO2↑+2H2O | |
| D. | 苏打溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH溶液中混有Ba(OH)2 (CuSO4) | B. | Cu(NO3)2中混有AgNO3 (Cu粉) | ||
| C. | CO中混有CO2(炽热的炭) | D. | CO2中混有HCl气体 (NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | 36.1 | |
| 燃烧热(kJ•mol-1) | 1560.7 | 2877.6 | 3535.6 |
| A. | 丁烷的沸点有可能在0℃以下 | |
| B. | 上述四种烷烃中戊烷最容易液化,打火机中所用的燃料就是戊烷 | |
| C. | 丙烷完全燃烧生成4mol气态水,所放出的热量小于2877.6kJ | |
| D. | 烷烃的含碳量越高,其燃烧热值也就越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000 ml | B. | 500 ml | C. | 1500 ml | D. | 100 ml |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com